时间:2025-06-26 00:15:20
1、填空题 (1)根据VSEPR模型: ClO3-的价层电子对的几何分布呈________型,离子的空间结构呈________型;
(2)CH2Cl2的价层电子对的几何分布呈________型,分子的空间结构呈___________型;
(3)按要求写出由第三周期元素为中心原子,通过sp3杂化形成中性分子的化学式:(各写一种)正四面体形分子________,三角锥形分子_________?,V形分子___________;
(4)与SO42-互为等电子体的微粒(举两例)________、________;
(5)金属钠的晶胞如下图所示,实验测得钠的密度为d(g·cm-3)。已知钠的相对原子质量为M,阿伏加德罗常数为NA(mol-1),假定金属钠原子为等径的刚性球且处于体对角线上的三个球相切。则钠原子的半径r(cm)为?_____________; 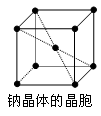
参考答案:(1)正四面体?;三角锥?
(2)正四面体?;四面体?
(3)SiH4?;PH3?;H2S?(合理答案均可)
(4)ClO4-?;SiO44-?(合理答案均可)?
(5)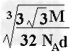
本题解析:
本题难度:一般
2、选择题 依据物质的相关数据,可以推断物质的结构和性质。下列利用物质的相关数据作出的相应推断不合理的是
[? ]
A.依据元素的原子序数,推断该元素原子的核外电子数
B.依据气体的摩尔质量,推断相同状况下不同气体密度的大小
C.依据物质摩尔质量,推断物质熔、沸点的高低
D.依据液体物质的沸点,推断用蒸馏法分离两种互溶液态物质组成的混合物的可行性
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列固体属于离子晶体的是
A.石墨
B.氯化钠
C.干冰
D.铁
参考答案:B
本题解析:离子间通过离子键形成的晶体是离子晶体,因此选项B正确,石墨是混合型的,干冰是分子晶体,铁是金属晶体,答案选B。
本题难度:简单
4、选择题 下列有关物质的熔点的比较中,不正确的是
A.晶体Si < 金刚石
B.CO2 < SiO2
C. NaCl < NaBr
D. PH3 < NH3
参考答案:C
本题解析:A 正确,原子晶体中,半径越小,熔点越高,碳原子的半径比硅原子的半径小,金刚石的熔点就高。
B 正确,原子晶体的熔点大于分子晶体的熔点。
C 错误,离子晶体中,半径越小,熔点越高,氯原子的半径小于溴原子的半径,故NaCl >NaBr
D 正确,氨气中存在氢键,所以,PH3 < NH3
本题难度:一般
5、选择题 在下列有关晶体的叙述中正确的是
A.晶体中有阳离子就一定存在阴离子
B.分子晶体中一定存在共价键和分子间作用力
C.金属晶体的熔点一定比分子晶体高
D.原子晶体中,一定只存在共价键
参考答案:D
本题解析:A.在金属晶体中有阳离子但是没有阴离子存在。错误。B.在分子晶体中一定存在分子间作用力,但是不一定存在共价键。如惰性气体就是单原子分子,没有化学键存在。错误。C.一般情况下金属晶体的熔点比分子晶体高,但是也有例外。如Hg在常温下是液体,而S单质为分子晶体,熔点S>Hg。错误。D.在原子晶体中,原子间以共价键结合形成空间网状结构,断裂较难,因此熔沸点高,硬度大,难溶于一般的溶剂。正确。
本题难度:一般