时间:2025-06-26 00:15:20
1、选择题 在某晶体中,与某一个微粒x距离最近且等距离的另一个微粒y所围成的空间构型为正八面体形(如图)。该晶体不是( )
A.NaCl(x=Na+,y=Cl-)
B.CsCl(x=Cs+,y=Cl-)
C.金属钋(Po)
D.MgO晶体
参考答案:B
本题解析:根据题干分析,与x最近且距离相等的有6个y,说明不是CsCl,氯化铯中应该是与x最近且距离相等的有8个y。
点评:属于较简单题。
本题难度:一般
2、选择题 下列关于晶体的说法一定正确的是(? )
A.分子晶体中都存在共价键
B.CaTiO3晶体中每个Ti4+和12个O2-相紧邻
C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D.金属晶体的熔点都比分子晶体的熔点高
参考答案:B
本题解析:A、惰性气体都是单原子分子,其晶体中不存在共价键,错误;B、题目所给晶体结构模型中每个Ti4+周围有3个O2-与之相邻,用均摊法不难求得晶体中每个Ti4+离子周围共有: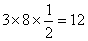 个O2-,正确;C、在SiO2的晶体中Si、O以单键相结合,因此每个硅原子与4个氧原子结合,错误;D、金属汞的熔点比I2、蔗糖等的熔点都低,错误。
个O2-,正确;C、在SiO2的晶体中Si、O以单键相结合,因此每个硅原子与4个氧原子结合,错误;D、金属汞的熔点比I2、蔗糖等的熔点都低,错误。
本题难度:一般
3、选择题 对“整块晶体可以看作是数量巨大的晶胞“无隙并置”而成”的理解错误的是
[? ]
A.晶胞之间没有任何间隙
B.晶体是晶胞的堆积
C.晶胞排列时,取向相同
D.“并置”是指晶胞都是平行排列的
参考答案:B
本题解析:
本题难度:简单
4、选择题 下表所列物质晶体的类型全部正确的一组是
| ? | 原子晶体 | 离子晶体 | 分子晶体 |
| ?A. | 氮化硅 | 磷酸 | 单质硫 |
| ?B. | 单晶硅 | 烧碱 | 白磷 |
| ?C. | 金刚石 | 硅铁 | 冰 |
| ?D. | 铁 | 尿素 | 冰醋酸 参考答案:B 本题解析:A中磷酸是分子晶体;C中硅铁不是晶体;D中铁是金属晶体,尿素是分子晶体; 本题难度:简单 5、简答题 已知A、B、C、D、E都是元素周期表中前36号的元素,其原子序数依次增大.A与其他4种元素既不在同一周期又不在同一族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第8列元素.D的原子序数比E小6,D跟B可形成离子化合物其晶胞结构如图.请回答: 参考答案:已知A、B、C、D、E都是元素周期表中前36号的元素,其原子序数依次增大,E是周期表中1-18列中的第8列元素,所以E是Fe元素;D的原子序数比E小6,所以D是Ca元素;D跟B可形成离子化合物,该晶胞中含有B离子8个,D离子个数8×18+6×12=4,所以该化学式为D2B,B为第VIIA族元素,B和C属同一主族,且B的原子序数小于C,所以B是F元素,C是Cl元素,A与其他4种元素既不在同一周期又不在同一族,所以A是H元素. 本题解析: 本题难度:一般 |