时间:2025-06-26 00:13:45
1、选择题 可逆反应A(?)+a B(g)? ?C(g)+2 D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是?
?C(g)+2 D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是?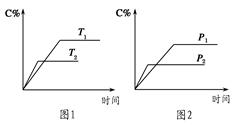
A.当压强由p1变为 p2时,逆反应速率将变大
B.该反应的正反应为放热反应
C.若a=2,则A为液态或固体
D.恒温恒容条件下,增加B的物质的量,B的转化率和该反应的化学平衡常数都将增大
参考答案:D
本题解析:A、根据图2可知,P2时反应时间短,反应速率快,所以?P2>P1,当压强由p1变为 p2时,逆反应速率将变大,正确;B、根据图1可知,T2时反应达平衡的时间短,反应速率快,当其他条件不变时,温度越高反应速率越快,所以T2>T1;温度升高,C的百分含量减小,平衡向左移动,升高温度平衡向吸热反应方向移动,所以该反应为放热反应,正确;C、根据图2知,压强变大,C的百分含量减小,平衡向左移动,所以反应逆向为气体物质系数减小的方向,则A为液态或固体,正确;D、恒温恒容条件下,增加B的物质的量,由于无法确定A的状态及a值,B的转化率是增大还是减小无法确定,温度不变该反应的化学平衡常数不变,错误。
本题难度:一般
2、选择题 下列方法中,可以加快铁与稀硫酸反应速率的是( )
A.加水
B.增大稀硫酸的浓度
C.增大压强
D.加入少量ZnCl2
参考答案:A、加水氢离子的浓度降低,反应速率减慢,故A错误;
B、增大稀硫酸的浓度,若仍为稀硫酸可以加快反应速率(注意若为浓硫酸,铁在浓硫酸中发生钝化现象),故B正确;
C、增大压强对固体、液体的浓度不影响,不能加快反应速率,故C错误;
D、加入少量ZnCl2液,铁的还原性比Zn弱,不能置换出锌,不能形成原电池,反应速率不加快,故D错误;
故选B.
本题解析:
本题难度:简单
3、填空题 (4分)在一定温度下将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下面空白。
2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下面空白。
(1)用D表示的平均反应速率为______。
(2) 若开始时只加C和D各4/3 mol,要使平衡时各物质的质量分数与原平衡相等,则还应加入_____ mol B物质。
参考答案:(4分)(1)0.2 mol·L-1·min-1 ?(2)4/3
本题解析:(1)反应速率通常用单位时间内浓度的变化量来表示,所以D的反应速率是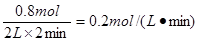 。
。
(2)由于容积不变,所以要满足平衡等效,则换算后的A、B的物质的量都等于0.2mol。C和D各4/3 mol,则相当于A、B是2mol和2/3mol,所以还需要B是2mol-2/3mol=4/3mol。
本题难度:一般
4、选择题 一定条件下,在容积固定的某密闭容器中发生的反应N2+3H2 2NH3。在10s内
2NH3。在10s内 的浓度由5mol/L降至4mol/L下列说法正确的是(?)
的浓度由5mol/L降至4mol/L下列说法正确的是(?)
A.用 表示的化学反应速率为0.1mol/(L·s)
表示的化学反应速率为0.1mol/(L·s)
B.使用合适的催化剂,可以加快该反应的速率
C.增加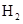 的浓度或降低温度都会加快该反应的速率
的浓度或降低温度都会加快该反应的速率
D.反应足够长时间,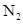 、
、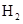 中至少有一种物质浓度降为零
中至少有一种物质浓度降为零
参考答案:B
本题解析:A:反应计量数之比为1:3:2,设容器的体积为V,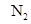 的浓度由5mol/L降至4mol/L,变化了1Vmol,所以
的浓度由5mol/L降至4mol/L,变化了1Vmol,所以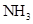 变化了2Vmol,V(
变化了2Vmol,V(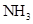 )=2V/10V(mol/L.s)=0.2mol/(L·s),故A错;B:正催化剂可以加快反应速率;C:该反应是在高温高压条件下进行,降低温度虽然平衡可以向右移动,但会降低反应速率,C错;D:反应是可逆反应,不可能反应物全部转化为生成物,D错,故选B
)=2V/10V(mol/L.s)=0.2mol/(L·s),故A错;B:正催化剂可以加快反应速率;C:该反应是在高温高压条件下进行,降低温度虽然平衡可以向右移动,但会降低反应速率,C错;D:反应是可逆反应,不可能反应物全部转化为生成物,D错,故选B
点评:要注意反应速率的判断与反应平衡移动的判断,是易错点,也是高考的常见考点。
本题难度:简单
5、选择题 汽车尾气的无害化处理的反应为2CO(g)+2NO(g) N2(g)+2CO2(g) △H<0下列说法不正确的是
N2(g)+2CO2(g) △H<0下列说法不正确的是
A.升高温度,正逆反应速率都加快
B.使用催化剂,正逆反应速率都加快
C.使用催化剂,可以降低活化能
D.升高温度,上述反应的平衡常数会增大
参考答案:D
本题解析:反应2CO(g)+2NO(g) N2(g)+2CO2(g) △H<0正反应方向为放热反应,所以
N2(g)+2CO2(g) △H<0正反应方向为放热反应,所以
A正确,升高温度反应速率加快;B正确,催化剂能加快反应速率;C正确,催化剂能降低反应反应需的活化能,加快反应速率;D错,升高温度,该反应向逆反应方向移动,平衡常数减小;
本题难度:一般