时间:2025-06-26 00:13:45
1、简答题 红矾钠(重铬酸钠:Na2Cr2O7-2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛.
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO-Cr2O3)利用以下过程来制取.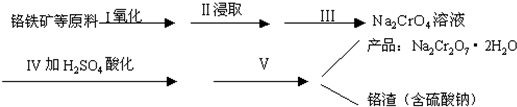
①步骤I中反应的化学方程式为:
4FeO-Cr2O3(s)+8Na2CO3(s)+7O2?
?8Na2CrO4(s)+2Fe2O3(s)+8CO2;△H<0
该反应的化学平衡常数的表达式为______.
②图1、图2表示该反应在t1时达到平衡、在t2时因改变某个条件而发生变化的曲线:
由图1判断,反应进行至t2min时,曲线发生变化的原因是______(用文字表达).
由图2判断,t2min到t3?min?的曲线变化的原因可能是______(填编号)
a.升高温度?b.加了催化剂?c.将原料粉碎?d.缩小容器体积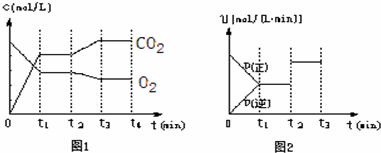
(2)步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是______、______.
①步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是______.
②步骤Ⅳ中发生反应的离子方程式为:______.
2、选择题 某一反应物的浓度是2.0 mol·L-1,经过4 min后,它的浓度变成1.68 mol·L-1,则在这4 min内它的平均反应速率为( )
A.0.2 mol·L-1·min-1
B.0.1 mol·L-1·min-1
C.0.04 mol·L-1·min-1
D.0.08 mol·L-1·min-1
3、填空题 .化学反应速率的大小首先取决于反应物本身的 不同.外界条件如 、 、 、 等也会对化学反应的速率产生影响。
4、简答题 在2七℃时,向100mL含氯化氢19.6g的盐酸溶液里放入七.60g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2min末,收集到1.12L(标准状况)氢气.在此之后,又经过9min,铁粉完全溶解.则
(1)在前2min?内用FeCl2表示的平均反应速率是______mol?L-1?min-1.
(2)在后9min内用HCl表示的平均反应速率是______mol?L-1?min-1.
5、实验题 将Zn投入一定浓度一定体积的盐酸中,H2的生成速率与时间的关系如图所示,试解释图中曲线变化的原因(纵坐标为H2的生成速率,横坐标为时间)。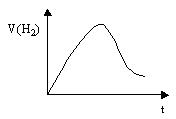
答:① ;
② 。