时间:2025-06-26 00:12:53
1、选择题 下列物质中,既能导电又属于电解质的是
A.铜丝
B.固体NaCl
C.熔融KNO3
D.NaOH溶液
2、填空题 电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
答下列有关问题
(1)预测周期表中电负性最大的元素应为____________;估计钙元素的电负性的取值范围:
___________< X <___________。
(2)根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是_________________________; 简述元素电负性X的大小与元素金属性、非金属性之间的关系_________________________________。
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为________,其理由是_____________________________。
3、选择题 属于能导电的电解质是
A.液态氯化氢
B.铁
C.酒精
D.熔融的氯化钠
4、选择题 下列是一些原子的2p能级和3d能级中电子排布的情况,其中违反了泡利不相容原理的是
[? ]
A.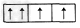
B.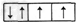
C.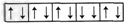
D.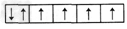
5、选择题 下列原子中第一电离能最大的是
[? ]
A.Na
B.Li
C.Be
D.Mg