时间:2025-06-25 23:59:00
1、填空题 如下图是一个乙醇燃料电池工作示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题: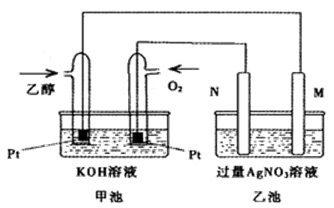
(1)M电极材料是 , N的电极反应式为 ,加入乙醇的铂电极的电极反应式为 。
(2)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出约为30kJ热量,表示乙醇燃烧热的热化学方程式为 。
(3)若M、N均为石墨电极,将乙池改为电解500mL含KNO3和Cu(NO3)2的混合液一段时间后,在两极上均生成11.2L(标准状况)气体。则M极产生的气体是H2,原混合液中Cu2+的物质的量浓度是 mol/L。
参考答案:(共8分)
(1)铁 (1分) 4OH—-4e—=2H2O+O2↑ (1分)C2H5OH-12e+16OH—=2CO32—+11H2O (2分)
(2)C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-1380kJ/mol (2分)
(3)1 mol/L (2分)
本题解析:(1)甲池是燃料电池,乙池是电解池,通入氧气的一极是正极,则N极是阳极,则M极是阴极,M、N两个电极的质量都不减少,则铁作阴极,所以M极的材料是铁;N极发生氧化反应,根据离子的放电顺序,则在N极放电的书写氢氧根离子,失去电子生成氧气,电极反应式为4OH—-4e—=2H2O+O2↑;加入乙醇的一极是原电池的负极,发生氧化反应,结合电解质溶液,生成碳酸根离子和水,电极反应式为C2H5OH-12e+16OH—=2CO32—+11H2O;
(2)1mol乙醇的质量是46g,所以1mol乙醇完全燃烧生成CO2和液态H2O时放出46×30kJ=1380kJ的热量,所以乙醇燃烧的热化学方程式为C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-1380kJ/mol ;
(3)若M、N均为石墨电极,将乙池改为电解500mL含KNO3和Cu(NO3)2的混合液,当M极放出氢气时,说明铜离子放电完全,N极产生氧气,根据4OH—-4e—=2H2O+O2↑,可知生成标准状况下11.2L氧气,失去电子的物质的量是11.2L/22.4L/mol×4=2mol,生成11.2L氢气时得到电子的物质的量是11.2L/22.4L/mol×2=1mol,则铜离子共得到1mol电子,根据Cu2++2e-==Cu,可知铜离子的物质的量是1/2mol,所以原混合液中Cu2+的物质的量浓度是1/2mol/0.5L=1.0mol/L。
考点:考查电化学反应原理的应用,氧化还原反应的计算
本题难度:一般
2、选择题 强酸与强碱的稀溶液发生中和反应的热化学方程式:H+(aq)+OH-(aq)=H2O(1)?⊿H=-57.3kJ/mol。向1L1mol/L的NaOH溶液中加入下列物质:①稀醋酸?②浓硫酸?③稀硝酸,恰好完全反应时的反应热⊿H1、⊿H2、⊿H3的关系正确的是(?)
A.⊿H1>⊿H2>⊿H3
B.⊿H1<⊿H3<⊿H2
C.⊿H1<⊿H2<⊿H3
D.⊿H1>⊿H3>⊿H2
参考答案:D
本题解析:醋酸是弱电解质,存在电离平衡,电离是吸热的,因此放出的热量少。浓硫酸溶于水放出大量的热,由于放热越多,△H越小,因此正确的答案选D。
本题难度:一般
3、选择题 下列叙述正确的是(?)
A.若温度升高则平衡常数一定增大
B.随温度的升高,碳酸钠溶液的pH减小
C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
D.c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、NO3-、Cl-能大量共存
参考答案:D
本题解析:对于吸热反应,温度升高则平衡常数一定增大,而对于放热反应,温度升高则平衡常数却减小,故A错误;碳酸根的水解是吸热过程,所以温度升高,促进其水解,使得pH增加,所以B错误;AgCl在同浓度的CaCl2和NaCl溶液中的溶解度不同,故C错误;
c(H+)/c(OH-)=1012的水溶液为强酸性溶液,而NH4+、Al3+、NO3-、Cl-在强酸性溶液中能大量共存,所以D正确。
点评:本题考查了离子共存、溶解度等知识点,本题有利于考查学生对化学基础知识的掌握情况,本题比较容易。
本题难度:简单
4、选择题 用标准盐酸测定NaOH溶液的浓度,甲基橙作指示剂,下列操作可能使测定结果偏低的是(?)
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色由黄色变橙色,立即记下滴定管内液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
参考答案:C
本题解析:A中,不润洗,则盐酸的浓度被稀释,所以消耗盐酸的体积偏大,浓度偏高;B中消耗的盐酸体积增加,浓度偏高;C中说明反应还没有达到滴定终点,所以浓度偏低;锥形瓶用氢氧化钠润洗,则消耗盐酸的体积增加,浓度偏高,答案选C。
本题难度:一般
5、选择题 Ⅰ.已知在常温常压下:
① 2CH3OH(l)十3O2(g)=2CO2(g)+4H2O(g)?△H= -1275.6 kJ·mol—1
② H2O(l)=H2O(g)?△H="+" 44.0 kJ.mo—1
写出表示甲醇燃烧热的热化学方程式?。
Ⅱ.磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如下图: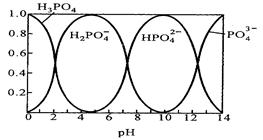
(1)在Na3PO4溶液中,c(Na+)/c(PO43-)??3(填“>”“=”“<”),向Na3PO4溶液中滴入稀盐酸后 ,pH从10降低到5的过程中发生的主要反应的离子方程式为??。
(2)从图中推断NaH2PO4溶液中各种微粒浓度大小关系正确的是?。(填选项字母)
A、C(Na+)> C(H2PO4 -)>? C(H+)>? C(HPO4 2-)> C(H3PO4 )
B、C(Na+)> C(H2PO4 -)>? C(OH-)>? C( H3PO4)> C(HPO4 2- )
C、C(H+)+ C(Na+)=C(OH-)+C(H2PO4-)+2C(HPO42-)+3C(PO43-)+C(H3PO4 )?
D、C(Na+)=C(H2PO4-)+C(HPO42-)+C(PO43-)+C(H3PO4 )?
(3)假设25℃条件下测得0.1 mol·L–1的Na3PO4溶液的pH=12 ,近似计算出Na3PO4的第一步水解的水解常数Kh(写出计算过程,忽略Na3PO4的第二、第三步水解,结果保留两位有效数字)。
Ⅲ.化学在环境保护中起着十分重要的作用,电化学降解法可用于治理酸性水中的硝酸盐污染。电化学降解NO3-的原理如图所示。电源正极为?(填A或B),阴极反应式为?。
参考答案:Ⅰ.CH3OH(g)+3/2 O2(g)= CO2(g)+2H2O(l)?△H=-725.8kJ/mol?(2分)
Ⅱ.(1)>? HPO4 2- +? H+=?H2PO4 -?(每空2分,共4分)
(2)AD(2分)
(3)? PO43-?+? H2O 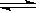 ?HPO4 2- +? OH-?(1分)
?HPO4 2- +? OH-?(1分)
起始浓度(mol·L–1): 0.1?0?0
变化浓度(mol·L–1): 0.01? 0.01? 0.01?
平衡浓度(mol·L–1): 0.09? 0.01? 0.01? (1分)
Kh?=C (HPO4 2-)× C(OH-)/? C( PO43- )=0.01 × 0.01 / 0.09 = 1.1 × 10 -3 mol·L–1
Ⅲ.?A? 2NO3-+10e-+12H+=6H2O +N2↑?(每空2分,共4分)
本题解析:Ⅰ.根据已知方程式和盖斯定律,甲醇燃烧的化学方程式为可由(①—②×4)÷2而得,因此表示甲醇燃烧热的热化学方程式为:CH3OH(g)+3/2 O2(g)= CO2(g)+2H2O(l)?△H=-725.8kJ/mol。
Ⅱ.(1)Na3PO4溶液中,PO43- 发生水解,因此c(Na+)/c(PO43-)>3,从磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线图可以看出,在pH从10降低到5的过程中,主要是HPO4 2- 的含量在逐渐减小为0,而H2PO4 – 的含量在逐渐增大,因此发生的主要反应的离子方程式为HPO4 2- +? H+=?H2PO4 - 。
(2)从图中可以看出,H2PO4 – 离子在酸性条件下才能大量存在,因此说明H2PO4 – 的电离大于水解,因此NaH2PO4溶液中有C(HPO4 2-)> C(H3PO4 ),又水电离出的一部分H+ ,因此离子浓度大小顺序有C(Na+)> C(H2PO4 -)>? C(H+)>? C(HPO4 2-)> C(H3PO4 ),因此A正确;由于H2PO4 – 发生水解和电离后,溶液中含P的微粒有H2PO4-、HPO42- 、PO43-、H3PO4?4种,因此电荷守恒式C错误;物料守恒式D正确。故选AD。
(3)根据溶液水解后的PH=12,可以计算水解产生的c(OH-)=0.01mol/L?,列成三段式有:
PO43-?+? H2O  ?HPO4 2- +? OH-?
?HPO4 2- +? OH-?
起始浓度(mol·L–1): 0.1?0?0
变化浓度(mol·L–1): 0.01? 0.01? 0.01?
平衡浓度(mol·L–1): 0.09? 0.01? 0.01?
Kh?=C (HPO4 2-)× C(OH-)/? C( PO43- )=?0.01 × 0.01 / 0.09 = 1.1 × 10 -3 mol·L–1
Ⅲ.从原理示意图中可以看出,该装置是一个电解池装置,要降解的硝酸盐变成了N2,因此在图中的右侧发生了还原反应,该极为阴极,电源的A极则是正极。阴极反应的方程式为:2NO3-+10e-+12H+=6H2O +N2↑。
本题难度:困难