时间:2025-06-25 23:54:49
1、选择题 设阿伏加德罗常数为NA,请你判断下列叙述中正确的是
A.2NA个HF分子所占的体积约为44.8L
B.46 g四氧化二氮和二氧化氮的混合气体中含有的原子数少于3NA
C.常温常压下,8.8 gCO2和N2O混合气体中所含的电子数为4.4NA
D.5.6 g铁与500 mL 2 mol · L-1硝酸反应,转移的电子数为0.2NA
参考答案:C
本题解析:A.不知道条件,所以无法确定一定物质的量的气体的体积,错误;B.46 g四氧化二氮和二氧化氮的混合气体中含有的原子数等于3NA,错误;C.常温常压下,8.8 gCO2和N2O混合气体的物质的量是0.2mol,由于每个分子中含有22个电子,所以所含的电子数为4.4NA,正确;D.Fe与硝酸反应的方程式是:Fe+4HNO3(稀)= Fe(NO3)3+NO↑ +2H2O; 3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O5.6 g铁的物质的量是0.1mol,n(HNO3)="0.5L×" 2 mol /L=1mol,n(HNO3):n(Fe)=10>4,可见硝酸过量,发生第一个反应,因此反应转移的电子数为0.3NA,错误。
考点:考查阿伏加德罗常数的计算的知识。
本题难度:一般
2、选择题 偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力。下列叙述正确的是
[? ]
A.偏二甲肼(C2H8N2)的摩尔质量为60 g
B.6. 02×1023个偏二甲肼(C2H8N2)分子的质量约为60 g
C.1 mol偏二甲肼(C2H8N2)的质量为60 g/mol
D.6 g偏二甲肼(C2H8N2)含有NA个偏二甲肼(C2H8N2)分子
参考答案:B
本题解析:
本题难度:简单
3、选择题 将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度为(?)
A.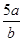 mol/L
mol/L
B.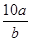 mol/L
mol/L
C.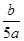 mol/L
mol/L
D.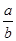 mol/L
mol/L
参考答案:B
本题解析:根据稀释过程中溶质不变可知,稀释后硝酸镁的浓度是5a/bmol/L。根据硝酸镁的化学式可知,溶液中NO3-的物质的量浓度为5a/bmol/L×2=10a/bmol/L,答案选B。
本题难度:一般
4、填空题 (8分)明矾的化学式为KAl(SO4)2 ?12H2O,相对分子质量为474。它是一种常用净水剂。
(1)明矾是电解质,写出它在水溶液中的电离方程式 。
(2)23.7g明矾中所含的K+和SO42-的物质的量之比为 ,水分子的质量为 。
(3)某明矾中含有1.204×1023个水分子,则该明矾的质量为 。
参考答案:(每空2分)
(1)KAl(SO4)2=K++Al3++2SO42- (2)1:2 10.8g (3)7.9 g
本题解析:(1)明矾是强电解质,在水中完全电离产生钾离子、铝离子、硫酸根离子,电离方程式为KAl(SO4)2=K++Al3++2SO42-;
(2)23.7g的明矾的物质的量是23.7g/(258+216)g/mol=0.05mol,所以水分子的物质的量是12×0.05mol=0.6mol,则水分子的质量是0.6mol×18g/mol=10.8g,由明矾的化学式可知,明矾中所含的K+和SO42-的物质的量之比即为个数比是1:2;
(3)1.204×1023个水分子的物质的量是1.204×1023/NA=0.2mol,则明矾的物质的量是0.2mol/12,则明矾的质量是0.2mol/12×474g/mol=7.9g。
考点:考查物质中微粒数的计算、比例关系的判断,电离方程式的书写
本题难度:一般
5、选择题 若NA表示阿伏加德罗常数,下列关于0.3mol /L的MgCl2溶液的说法正确的是(?)
A.100毫升的溶液中含有Mg2+、Cl-—总数为0.3NA
B.100毫升的溶液中含有Mg2+数目是0.1NA
C.1升溶液中Mg2+的浓度是0.3mol / L
D.1.5升溶液中含有Cl-的浓度是4.5mol / L
参考答案:C
本题解析:首先明确溶质、其中微粒的浓度与溶液的体积无关,故溶液中Mg2+的浓度是0.3mol / L、Cl-的浓度是0.6mol / L,答案为C,排除D
在100毫升(0.1L)的溶液中Mg2+、Cl-的个数分别为:0.1×0.3NA、0.1×0.6NA,共0.09NA,排除AB
本题难度:一般