时间:2025-06-25 23:50:49
1、填空题 如图甲、乙是电化学实验装置。
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为_________________________;
②乙中总反应的离子方程式为________________________;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5 ∶1,且生成两种酸,该反应的化学方程式为_________________。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为______________________;
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入________(填写物质的化学式)________g。
参考答案:(1)①O2+2H2O+4e-==4OH-;②2Cl-+2H2O 2OH-+H2↑+Cl2↑;③5Cl2+I2+6H2O==2HIO3+10HCl
2OH-+H2↑+Cl2↑;③5Cl2+I2+6H2O==2HIO3+10HCl
(2)①Fe-2e-==Fe2+;②CuO;0.8(或CuCO3;1.24)
本题解析:
本题难度:一般
2、选择题 锂-钒氧化物电池的能量密度远远超过其他材料电池,电池总反应式为xLi+V2O5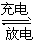 LixV2O5,下列说法正确的是
LixV2O5,下列说法正确的是
[? ]
A.放电时,锂离子向负极移动?
B.放电时,负极上反应的物质是锂,正极上反应的物质是V2O5
C.放电时,负极的电极反应为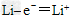 ?
?
D.充电时,V2O5在阴极被还原
参考答案:BC
本题解析:
本题难度:一般
3、填空题 食盐是重要的化工原料,电解饱和食盐水的化学方程式:________________________,电解食盐水中加入了几滴酚酞试液,接通电源,阳极产生____________,以____________试纸检验,还可以看到____________极附近的溶液变红,检验阴极气体的方法是______________。将其中两种产物化合又可以得到氯化氢,属于________(强、弱、非)电解质,将其溶于水后的电离方程式为__________________。
参考答案:2NaCl+2H2O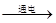 2NaOH+H2↑+Cl2↑;Cl2;湿润的淀粉碘化钾;阴;爆鸣实验;强;HCl=H++Cl-
2NaOH+H2↑+Cl2↑;Cl2;湿润的淀粉碘化钾;阴;爆鸣实验;强;HCl=H++Cl-
本题解析:电解饱和食盐水,生成氢氧化钠、氢气和氯气,2NaCl+2H2O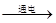 2NaOH+H2↑+Cl2↑,阴极生成氢氧化钠和氢气,阳极生成氯气,检验氯气用湿润的淀粉碘化钾试纸,氢氧化钠为强碱,遇酚酞后溶液呈红色,氢气是易燃易爆的起头,通常检验时用爆鸣实验,氢气和氯气化合可得到氯化氢气体,溶于水后生成盐酸,盐酸为强电解质,可电离生成氢离子和氯离子HCl=H++Cl-。
2NaOH+H2↑+Cl2↑,阴极生成氢氧化钠和氢气,阳极生成氯气,检验氯气用湿润的淀粉碘化钾试纸,氢氧化钠为强碱,遇酚酞后溶液呈红色,氢气是易燃易爆的起头,通常检验时用爆鸣实验,氢气和氯气化合可得到氯化氢气体,溶于水后生成盐酸,盐酸为强电解质,可电离生成氢离子和氯离子HCl=H++Cl-。
考点:点解饱和食盐水的相关知识
本题难度:困难
4、选择题 右图所示装置中,a、b、c、d、e、f均为惰性电极,电解质溶液均足量。接通电源后,d极附近显红色。下列说法正确的是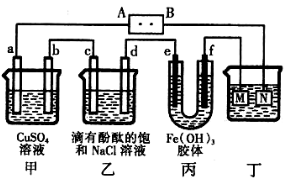
A.电源B端是正极
B.a、c电极均有单质生成,其物质的量之比为2:1
C.欲用丁装置给铜镀银,N应为Ag,电解液为AgNO3溶液
D.f极附近变红,说明氢氧化铁胶粒带正电荷
参考答案:D
本题解析:D附近显红色,说明电解饱和食盐水时,电极d是阴极,即A是正极,B是负极,甲池中a极OH-放电,b极Cu2+被还原;丙池中Fe(OH)3胶粒带正电荷,向阴极f极移动,f极附近颜色加深;若用丁装置铜镀银,即纯铜做N极,银做M极。
本题难度:一般
5、选择题 下列有关用惰性电极电解AgNO3溶液一段时间后的说法错误的是( )
A.电解过程中阴极质量不断增加
B.电解过程中溶液的pH不断降低
C.此时向溶液中加入适量的Ag2O固体可使溶液恢复电解前的状况
D.电解后两极产生的气体体积比为2:1
参考答案:A.电解过程中阴极银离子放电,生成单质Ag,则阴极质量增加,故A正确;
B.由4AgNO3+2H2O?电解?.?4Ag+O2↑+4HNO3,生成硝酸,溶液的酸性增强,pH不断降低,故B正确;
C.由电解反应可知,从溶液中析出单质Ag和氧气,则可向溶液中加入适量的Ag2O固体可使溶液恢复电解前的状况,故C正确;
D.电解时只有阳极生成氧气,故D错误;
故选D.
本题解析:
本题难度:一般