时间:2025-06-25 23:50:49
1、填空题 根据右图回答以下问题: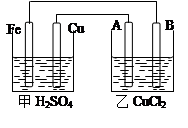
(A、B均为碳棒,两池中溶液均足量)
(1)甲装置是 池,乙装置是 池且Fe极为 极,A极为 极
(2)A极的电极反应
(3)若甲池中Fe溶解0.3 mol,则乙池中产生气体的体积(标准状况)为 L,
参考答案:(1)原电池;电解池;负极;阳极 (2)2Cl----2e- == Cl2↑ (3)6.72
本题解析:(1)原电池中一般存在2个活性不同的两极,所以该装置中甲池是原电池,乙是电解池;铁作负极,铜作正极,则A是阳极;
(2)A是阳极发生氧化反应,阴离子放电,所以氯离子得电子生成氯气,电极反应式为2Cl----2e- == Cl2↑;
(3)若甲池中Fe溶解0.3 mol,则装置中转移0.6mol电子,乙池中只有A极产生0.3mol氯气,标准状况下的体积是0.3mol×22.4L/mol=6.72L。
考点:考查对电化学装置的判断,电化学原理的应用
本题难度:困难
2、填空题 (14分)催化剂是化工技术的核心,绝大多数的化工生产均需采用催化工艺。
⑴人们常用催化剂来选择反应进行的方向。下图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。在有催化剂作用下,CH3OH与O2反应主要生成 (填“CO、CO2或HCHO”)。
②2HCHO(g)+O2(g)=2CO(g)+2H2O(g)
△H= 。
③在稀硫酸催化下,HCHO可以通过反应生成分子式为C3H6O3的环状三聚甲醛分子,其分子中同种原子的化学环境均相同。写出三聚甲醛的结构简式: 。
④甲醇制取甲醛可用Ag作催化剂,含有AgCl会影响Ag催化剂的活性,用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式: 。
⑵一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 ;每吸收标准状况下11.2L SO2,被SO2还原的O2的质量为
g。
②利用下图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。
参考答案:⑴①HCHO ;②-470kJ·mol-1;③ ;
;
④AgCl+2NH3·H2O=Ag(NH3)2++Cl-+2H2O或AgCl+2NH3=Ag(NH3)2++Cl-
⑵①防止酸雨的发生 ;8;②SO2+2H2O+Cu2+ 4H++SO42
4H++SO42
本题解析:
本题难度:一般
3、选择题 如图为阳离子交换膜法电解饱和食盐水原理示意图,其中的阳离子交换膜仅允许Na+通过。下列说法错误的是
A.a极的电极反应式为:2 H++ 2 e H2 ↑
H2 ↑
B.D口导出的是NaOH溶液
C.浓盐水从A口注入
D.C口导出的是NaOH和NaCl的混合溶液
参考答案:D
本题解析:A.钠离子向a极移动,则a为阴极,发生2H++2e﹣=H2↑,故A正确;B.阴极生成OH﹣,且Na+向阴极移动,则产品烧碱溶液从D口导出,故B正确;C.电解时,阳极生成氯气,消耗NaCl,则应在阳极补充NaCl,即浓盐水从A口注入,故C正确;D.阳离子交换膜仅允许Na+通过,则在C口不可能有NaOH导出,故D错误。故选D。
本题难度:一般
4、选择题 氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应是 根据此反应式判断,下列叙述中正确的是
根据此反应式判断,下列叙述中正确的是
[? ]
A.电池放电时,电池负极周围溶液的pH不断增大
B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原
D.电池放电时,H2是负极
参考答案:CD
本题解析:
本题难度:一般
5、填空题 (15分)甲醇是一种可再生能源,又是一种重要的化工原料,具有开发和应用的广阔前景。工业上可用如下方法合成甲醇:
| 方法一 | CO(g) +2H2(g)  CH3OH(g) CH3OH(g) |
| 方法二 | CO2(g) +3H2(g)  CH3OH(g) H2O(g) CH3OH(g) H2O(g) |
 2CO2(g) + 4H2O(g) △H=-1275.6 kJ?mol-1
2CO2(g) + 4H2O(g) △H=-1275.6 kJ?mol-1 2CO2(g) △H=-566.0 kJ?mol-1
2CO2(g) △H=-566.0 kJ?mol-1
参考答案:(1)CH3OH(l) + O2(g)=CO(g) + 2H2O(l) △H=-442.8kJ?mol-1 (2分)
(2)①0.08mol/(L?min) (2分) <(2分) ②100(2分) ③ >(2分)
(3)①VO2+—e—+2H+=VO2++H2O (2分)
②由绿色变为紫色(1分) ③8.685×104C(2分)
本题解析:(1)已知:① 2CH3OH(l) + 3O2(g) 2CO2(g) + 4H2O(g) △H=-1275.6 kJ?mol-1,② 2CO(g) + O2(g)
2CO2(g) + 4H2O(g) △H=-1275.6 kJ?mol-1,② 2CO(g) + O2(g) 2CO2(g) △H=-566.0 kJ?mol-1,③H2O(l)=H2O(g) △H =" +" 44.0 kJ?mol-1,则根据盖斯定律可知(①—②—③×4)÷2即得到甲醇不完全燃烧生成CO和液态水的热化学反应方程式CH3OH(l) + O2(g)=CO(g) + 2H2O(l) △H=-442.8kJ?mol-1。
2CO2(g) △H=-566.0 kJ?mol-1,③H2O(l)=H2O(g) △H =" +" 44.0 kJ?mol-1,则根据盖斯定律可知(①—②—③×4)÷2即得到甲醇不完全燃烧生成CO和液态水的热化学反应方程式CH3OH(l) + O2(g)=CO(g) + 2H2O(l) △H=-442.8kJ?mol-1。
(2)①5分钟反应达平衡,此时CO的转化率为80%,则消耗CO是0.8mol,根据方程式CO(g) +2H2(g) CH3OH(g)可知生成甲醇是0.8mol,浓度是0.4mol/L,因此前5分钟内甲醇的平均反应速率为0.4mol/L÷5min=0.08mol/(L?min);已知该反应在低温下能自发进行,由于正方应是体积减小的,即△S<0,则根据△G=△H—T·△S可知,该反应为放热反应,即△H<0。
CH3OH(g)可知生成甲醇是0.8mol,浓度是0.4mol/L,因此前5分钟内甲醇的平均反应速率为0.4mol/L÷5min=0.08mol/(L?min);已知该反应在低温下能自发进行,由于正方应是体积减小的,即△S<0,则根据△G=△H—T·△S可知,该反应为放热反应,即△H<0。
②消耗CO是0.8mol,则平衡时氢气和CO的物质的量分别是0.4mol和0.2mol,浓度分别是0.2mol/L和0.1mol/L,化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则在该温度下反应的平衡常数K= 。
。
③某时刻向该平衡体系中加入CO、H2、CH3OH各0.2mol后,瞬间CO、氢气和甲醇的浓度分别变为0.2mol/L、0.3mol/L、0.5mol/L,则此时浓度商=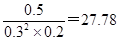 <100,因此平衡向正反应方向进行,所以将使ν正>ν逆。
<100,因此平衡向正反应方向进行,所以将使ν正>ν逆。
(3)①当左槽溶液逐渐由黄变蓝,说明VO2+转化为VO2+,即V元素的化合价从+3价升高到+4价,则其电极反应式为VO2+—e—+2H+=VO2++H2O。
②充电过程中,右槽中电极与电源负极相连,作阴极V3+得到电子转化为V2+,因此溶液颜色变化是由绿色变为紫色。
③4.8g甲醇的物质的量是4.8g÷32g/mol=0.15mol,在反应中失去0.15mol×6=0.9mol电子,所以电路中转移的电量的为9.65×l04C·mol-1×0.9mol=8.685×104C。
考点:考查盖斯定律的应用、平衡状态计算、反应自发性以及电化学原理的应用
本题难度:困难