时间:2025-06-25 23:49:59
1、选择题 在25℃水中加入下列物质,不会使水的电离平衡发生移动的是:
A.KI
B.浓氨水
C.冰醋酸
D.热水
2、选择题 下列描述中正确的是
A.HCl和NaOH反应的中和热△H=-57.3kJ·mol-1,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3) kJ·mol-1
B.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H= + 2×283.0 kJ·mol-1
C.牺牲阳极阴极保护法是应用电解原理防止金属的腐蚀
D.用洁净玻璃棒蘸取某溶液点在湿润的pH试纸上,与标准比色卡对比即可测定该溶液pH
3、填空题 (6分)现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵,⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)?。
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)?
(3)将②和③等体积混合后,混合液中各离子浓度由大到小的顺序是
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”) ?25℃。在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b= ?。
(5)若室温时pH=a的氨水与pH=b的盐酸等体积混合,恰好完全反应,则该氨水的电离度可表示为 ?
4、填空题 (12分)(1)氯化铁水解的离子方程式为?,向氯化铁溶液中加入碳酸氢钠溶液,发现有红褐色沉淀生成,并产生无色气体,其离子方程式为?。
(2)向盛有1mL 0.1mol/L MgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到的现象是白色沉淀转变为红褐色沉淀。产生该现象的原因是?。?
(3)25℃,向100mL pH=12的NaOH溶液加入pH=10的NaOH溶液1000 mL,混合后溶液体积1100 mL ,pH=?。?
(4)常温下,将0.1000 mol?L-1 NaOH溶液滴入20.00 mL 0.1000 mol?L-1的一元弱酸HA溶液中,刚好完全反应,则c(Na+)??c(A-)。(填“>”、“<”或“=”)
(5)某有机物结构为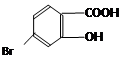 ,它的含氧官能团名称为?、?。?
,它的含氧官能团名称为?、?。?
5、选择题 已知某温度下,0.l mol·L-1NaHB溶液中,C(H+)>c(OH-),则下列各关系式一定正确的是
A.c(Na+)=c(HB-)+2c(B2-)+c(OH-)
B.溶液的pH="1"
C.c(Na+)="0.l" mol·L-1≥c(B2-)
D.C(H+).c(OH-)=10-14