时间:2025-06-25 23:49:59
1、选择题 向体积为Va的0.1mol·L-1?CH3COOH溶液中加入体积为Vb的0.1mol·L-1 KOH溶液,下列关系错误的是(? )
A.Va>Vb时:c(CH3COOH) + c(CH3COO-)> c(K+)
B.Va=Vb时:c(CH3COOH) + c(H+) = c(OH-)
C.Va<Vb时:c(CH3COO-) > c(K+)> c(OH-)>(H+)
D.Va与Vb任意比时:c(K+)+ c(H+) =c(OH-)+ c(CH3COO-)
2、选择题 常温下,用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如下图。下列说法正确的是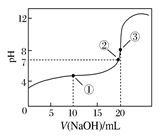
A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
3、选择题 某酸溶液的PH为2 ,某碱溶液的PH为12 ,两者等体积相混合后,有关PH值的变化正确的是(?)
A.大于7
B.小于7
C.等于7
D.三种都有可能
4、填空题 (7分)(1)室温下,把1 mL 0.1 mol·L-1的H2SO4加水稀释成2 L溶液,在此溶液中由水电离产生的H+,其浓度接近于?
(2)室温时,将0.1 mol/L盐酸和0.07mol/L氢氧化钡溶液1:5(体积比)混合后,该混合溶液的pH=_______
(3)某温度时,0.1 mol·L-1NaOH溶液的pH=12。该温度下,10体积pH=a的某强酸与1体积pH=b的某强碱混合后,溶液呈中性,则a和b满足的关系____________________
5、选择题 人体胃液中含有一定浓度的盐酸,若大量喝水,则胃液的pH与所喝入水的体积(V)关系曲线表达正确的是(? )