时间:2025-06-25 23:45:55
1、选择题 下列结论错误的是( )
A.微粒半径:K+>Na+>Al3+>Cl-
B.氢化物的稳定性:HCl>H2S>PH3>SiH4
C.酸性:H2SO4>H3PO4>H2CO3>HClO
D.金属性:Be<Mg<Ca<K
参考答案:A.电子层数越多,其离子半径越大,相同电子层结构的离子,离子半径随着原子序数的增大而减小,电子层数:钾离子、氯离子大于钠离子、铝离子,钾离子原子序数大于氯离子,铝离子原子序数大于钠离子,所以离子半径大小顺序是:Cl->K+>Na+>Al3+,故A错误;
B.同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其氢化物越稳定,元素的非金属性:Cl>S>P>Si,所以其氢化物的稳定性:HCl>H2S>PH3>SiH4,故B正确;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,元素的非金属性:S>P>C,所以酸性H2SO4>H3PO4>H2CO3,虽然Cl元素的非金属性较强,但次氯酸是弱酸,酸性小于碳酸,则这几种酸的酸性强弱顺序是:H2SO4>H3PO4>H2CO3>HClO,故C正确;
D.同一主族中,元素的金属性随着原子序数的增大而增强,所以金属性Be<Mg<Ca,同一周期元素中,元素的金属性随着原子序数的增大而减弱,所以金属性K>Ca,则这几种金属的金属性强弱顺序是:Be<Mg<Ca<K,故D正确;
故选A.
本题解析:
本题难度:简单
2、选择题 下列关于环境、能源和材料的叙述中不正确的是( )
A.氮化硅、光导纤维均属于新型无机非金属材料
B.日本福岛核电站泄漏的放射性核素131I与127I属于同素异形体
C.在西部和沿海地区兴建风力发电站,可缓解能源短缺问题
D.铁质器具表面刷漆或将其置于干燥处保存,均能有效减缓铁的锈蚀
参考答案:B
本题解析:
本题难度:一般
3、选择题 下列关于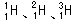 的说法正确的是( )
的说法正确的是( )
A.它们的中子数相同
B.它们是相同的原子
C.它们的性质相似
D.它们是氢元素的三种同位素
参考答案:D
本题解析:
本题难度:简单
4、选择题 NH4HCO3是一种离子化合物,下列关于该物质的叙述错误的是( )
A.所含四种元素的原子半径由小到大的顺序为:H<O<N<C
B.同周期的三种元素的得电子能力由大到小的顺序为:O>N>C
C.除去NaCl固体中混有少量的NH4HCO3固体可以采用加热的方法
D.其与足量氢氧化钠溶液共热的离子方程式为:NH4++OH-
参考答案:A.C、N、O位于相同周期,同周期元素从左到右,原子半径逐渐减小,则半径由小到大的顺序为:H<O<N<C,故A正确;
B.同周期元素从左到右元素的非金属性逐渐增强,则得电子能力由大到小的顺序为:O>N>C,故B正确;
C.碳酸氢铵加热易分解,生产环氨气、二氧化碳和水,可用加热的方法除杂,故C正确;
D.与足量氢氧化钠溶液共热生成氨气、碳酸钠和水,反应的离子方程式为HCO3-+NH4++2OH-△
本题解析:
本题难度:简单
5、选择题 下列叙述正确的是
[? ]
A.同一主族的元素,原子半径越大,其单质的熔点一定越高
B.同一周期元素的原子,半径越小越容易失去电子
C.同一主族元素的氢化物相对分子质量越大,它的沸点一定越高
D.稀有气体元素的原子序数越大,其单质的沸点一定越高
参考答案:D
本题解析:
本题难度:一般