时间:2025-06-25 23:44:16
1、选择题 根据表中信息判断,下列选项不正确的是?
| 序号 | 反应物 | 产物 |
| ① | KMnO4 、H2O2?、H?2SO4 | K2SO4 、MnSO4?...... |
| ② | Cl?2 、FeBr?2 | FeCl3、FeBr3 |
| ③ | MnO4- ?...... | Cl2 、Mn2+ ...... |
2、选择题 R、X、Y和Z是四种元素,其常见化合价均为+2价。且X2+与单质R不反应;X2++Z=X+Z2+;
Y+Z2+=Y2++Z。这四种离子的氧化性大小符合
[? ]
3、选择题 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-;2Fe3++2I-═2Fe2++I2.则下列有关说法中,不正确的是( )
A.还原性:I->Fe2+>Br-
B.原混合溶液中FeBr2的物质的量为6mol
C.当通入2mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl-
D.原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3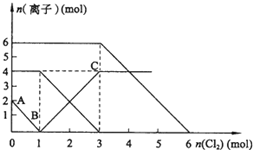
4、选择题 已知反应2X-+Z2=2Z-+X2,2W-+X2=2X-+W2能从左向右进行,则反应:W2+2Z-=Z2+2W-进行的方向是( )
A.从左向右
B.从右向左
C.不能进行
D.无法判断
5、选择题 X、Y、Z、M代表四种金属元素。金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子。则这四种金属的活动性由强到弱的顺序为
A.M>Z>X>Y
B.X>Y>Z>M
C.X>Z>Y>M
D.X>Z>M>Y