时间:2025-06-25 23:44:16
1、选择题 常温下,在溶液中可发生以下反应:①16H++10Z-+2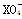 ===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,由此判断下列说法错误的是( )
===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,由此判断下列说法错误的是( )
A.氧化性强弱顺序为: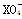 <Z2<R2<M3+
<Z2<R2<M3+
B.还原性强弱顺序为:X2+<Z-<R-<M2+
C.Z元素在反应①中被氧化,在③中被还原
D.常温下可发生反应2M2++Z2===2M3++2Z-
2、选择题 往AgNO3、Cu(NO3)2和Zn(NO3)2的混合溶液中加入一定量的铁粉,充分反应后,发现有少量金属析出,过滤后往滤液中滴加盐酸有白色沉淀生成,则析出的少量金属一定是
A.Ag
B.Cu
C.Fe
D.Zn
3、选择题 在常温下,发生下列几种反应?2KMnO4+ 16HCl = 2KCl + 2MnCl2+ 5Cl2↑ +8H2O
?Cl2 + 2NaBr = 2NaCl + Br2?Br2+ 2FeBr2?= 2FeBr3
根据上述反应,下列结论正确的是
A.还原性强弱顺序为:Br—>Fe2+>Cl—
B.氧化性强弱顺序为:MnO4—>Cl2>Br2>Fe3+
C.反应?中,当生成1molCl2时,被氧化的HCl为3.2mol
D.溶液中可发生反应:2Fe3+ + 2Cl—= 2Fe2+ + Cl2↑
4、实验题 (7分) 在足量的稀氯化亚铁溶液中加入1~2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为是Br2溶于水变成黄色溶液;乙认为是Fe2+被氧化成Fe3+使溶液变成黄色。
(2)现提供试剂:
A.酸性高锰酸钾溶液
B.氢氧化钠溶液
C.四氯化碳
D.硫氰化钾溶液
请判断?(填“甲”或“乙”)的推断正确,并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
| ? | 选用试剂 | 实验现象 |
| 第一种方法 | ? | ? |
| 第二种方法 | ? | ? |
5、选择题 已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+=Fe3++Ce3+
Sn2++2Fe3+=2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是
A.Sn2+、Fe2+、Ce3+
B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+、Sn2+
D.Fe2+、Sn2+、Ce3+