时间:2025-06-25 23:40:11
1、选择题 下列说法不正确的是
A.HCl、HBr、HI的熔点沸点升高与范德华力大小有关
B.H2O的熔点沸点大于H2S的是由于H2O分子之间存在氢键
C.乙醇与水互溶可以用相似相溶原理解释
D.甲烷与水分子间不能形成氢键这种化学
参考答案:D
本题解析:A、HCl、HBr、HI三种物质形成的晶体均是分子晶体,其熔点沸点升高与范德华力大小有关,A正确;B、由于水分子间存在氢键,因此H2O的熔点沸点大于H2S的沸点,B正确;C、乙醇和水都是极性分子,因此乙醇与水互溶可以用相似相溶原理解释,C正确;D、甲烷不能形成氢键,D不正确,答案选D。
本题难度:一般
2、选择题 A、B、C、D、E是同周期元素(非零族元素),A、B的最高价氧化物的水化物呈碱性,且B比A的碱性强,C、D最高价氧化物水化物是酸,且C比D的酸性强,E是这五种元素中原子半径最大的,则它们的核电荷数由小到大的顺序是( )
A.E<C<D<B<A
B.D<B<C<A<E
C.E<B<A<D<C
D.A<B<C<D<E
参考答案:因A、B、C、D、E是同一周期的五种元素,
A和B的最高价氧化物对应的水化物显碱性,且碱性B>A,则金属性B>A,
最高价氧化物水化物是酸,且C比D的酸性强,则非金属性C>D,
由同周期元素从左到右,元素的金属性减弱,非金属性增强,
则A、B、C、D的原子序数由小到大的顺序为B<A<D<C,
又E是这五种元素中原子半径最大的,同周期元素从左到右,原子半径在逐渐减小,故E的原子序数最小,
所以五种元素的原子序数由小到大的顺序为E<B<A<D<C.
故选:C.
本题解析:
本题难度:简单
3、填空题 【物质结构与性质】(15分)
根据元素周期表中第四周期元素的相关知识,回答下列问题:
(1)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有_______种;
写出Cu+的核外电子排布式_________。
(2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元素有___________种,属于d区的元素有________种。
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为________;CaO的焰色反应为砖红色,许多金属或它们的化合物都可以发生焰色反应,其原因是________。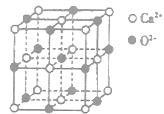
(4)由叠氮化钾(KN3)热分解可得纯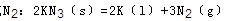 ,下列有关说法正确的是________(填选项字母)。
,下列有关说法正确的是________(填选项字母)。
A.NaN3与KN3结构类似,前者晶格能较小
B.晶体钾的晶胞结构如右图所示,每个晶胞中分摊2个钾原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮的电负性小
(5)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂。O2在其催化作用下,可将CN-氧化成CNO-。CN-的电子式为________,CNO-的中心原子的杂化方式为____________。
(6)在CrCl3溶液中,一定条件下存在组成为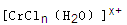 (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应: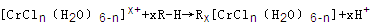
将含0.0015mol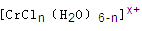 的溶液,与R-H完全交换后,中和生成的需浓度为
的溶液,与R-H完全交换后,中和生成的需浓度为
0.1200 mol/LNaOH溶液25.00 mL,则该配离子的化学式为____________。
参考答案:(1)? 3 (1分) 1s22s22p63s23p63d10(1分)
(2)? 2 (1分) 8(1分)
(3)? 6 (1分)?激发态的电子从能量高的轨道跃迁到能量较低的轨道时,以一定波长光的形式释放能量。 (2分,给分点:电子跃迁、释放能量)
(4) B C?(2分,各1分,错选不得分)
(5)?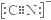 ?(2分) ?sp杂化 (2分)
?(2分) ?sp杂化 (2分)
(6) [CrCl(H2O)5]2+(2分)
本题解析:(1)4s轨道上只有1个电子的元素有K、Cr、Cu三种元素;Cu原子序数为29,核外电子排布式为:1s22s22p63s23p63d104s1,Cu+失去最外层电子,即失去了4s轨道的电子,故答案为:3;1s22s22p63s23p63d10;
(2)s区包括第ⅠA、ⅡA族,第四周期只有两种元素位于这两族;d区包括元素周期表从第三列到第十列,共8种元素;故答案为:2;8;
(3)观察该晶体属于NaCl型,其配位数为6,当电子受到激发,再从激发态跃迁的基态时释放能量,发出特定波长的光,故答案为:6、激发态的电子从能量高的轨道跃迁到能量较低的轨道时,以一定波长光的形式释放能量;
(4)A.离子半径小,晶格能越大,钠离子半径小于钾离子,故A错误;
B.根据均摊法计算,钾原子位于顶点和体心,每个晶胞含钾原子为8×1/8+1=2,故B正确;
C.氮原子价电子排布式为2s22p3,2p轨道半充满,较为稳定,第一电离能大于氧原子,故C正确;
D.氮气分子内形成氮氮三键,所以其化学性质稳定,并不是因为电负性小,故D错误;
故答案为:BC;
(5)C原子最外层四个电子,形成四对共用电子对,N原子最外层有五个电子,形成三对共用电子对,CN-得到一个电子,可写出电子式为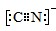 ;该离子与CO为等电子体,与CO杂化类型一致,CO的价电子对数=4/2=2,为sp杂化;
;该离子与CO为等电子体,与CO杂化类型一致,CO的价电子对数=4/2=2,为sp杂化;
(6)c(H+)=c(NaOH)=0.1200mol?L-1×25.00mL×10-3=0.003mol,根据方程式,和0.0015mol[CrCln(H2O)6-n]x+,x=2,所以离子中配体Cl-个数为1,可写出离子式:[CrCl(H2O)5]2+.
本题难度:一般
4、选择题 在等物质的量的短周期金属A和B中,分别加入足量的酸,A中加入盐酸,在B中加入稀硫酸,反应完全后,生成氢气的体积分别为V(A)和V(B),而且V(A)≠V(B)。若要确定反应生成物A和B的化合价,至少还需要知道的数据是(? )
A.V(A)∶V(B)的值?
B.V(A)或V(B)的值
C.A(或B)的物质的量?
D.盐酸或硫酸的物质的量浓度
参考答案:A
本题解析:题目涉及了一定的知识面,包括元素周期表、金属与酸的反应、物质的量以及化合价等,均为我们较熟悉的知识。在元素周期表中,短周期元素的金属单质都处于金属活动顺序表内氢以前,因而它们与盐酸、稀硫酸都可以发生置换反应。由于所用的酸都是过量的,因此用什么酸以及所用的酸的浓度是多少无关紧要,这样就首先排除了选项D。从金属单质与过量酸进行置换反应的化学方程式中可以看出,当金属的物质的量相同时,而金属元素的化合价不同,生成的氢气体积也不同。这种判断是解决本题的重要关键。由上述判断可知,只要知道了V(A)与V(B)之比,就可以知道两种金属元素的化合价。这是因为,若m、n分别是A、B的化合价,下式可以成立:m/n="V(A)/V(B)?" 由于A、B两元素的化合价只可能是+1、+2或+3,知道了它们化合价之比,也就可确定出它们的化合价。
本题难度:简单
5、选择题 下列物质所对应的化学式正确的是( )
A.烧碱--Ca(OH)2
B.胆矾--CuSO4
C.过氧化钠--Na2O
D.石膏--CaSO4?2H2O
参考答案:A、烧碱是氢氧化钠,化学式为NaOH,故A错误;
B、胆矾是硫酸铜晶体,化学式为CuSO4?5H2O,故B错误;
C、过氧化钠是钠离子与过氧根离子形成的离子化合物,化学式为Na2O2,故C错误;
D、石膏的化学式为CaSO4?2H2O,故D正确.
故选D.
本题解析:
本题难度:一般