时间:2025-06-25 23:40:11
1、选择题 元素的原子结构决定其性质和在周期表中的位置,下列说法正确的是( )
A.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
B.某微粒的结构示意简图为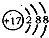
,则该元素在周期表中位于第三周期、VIA族
C.Be(OH)2的碱性比Mg(OH)2的碱性强
D.原子半径:Na>Si>O
2、选择题 M、N、X、Y四种短周期主族元素在元素周期表中的相对位置如图所示。已知它们的原子序数总和为48,则下列有关说法中不正确的是 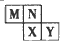
[? ]
A.N与X位于元素周期表中ⅥA族
B.M、X、Y三种元素的最高价氧化物对应的水化物均为强酸
C.M的气态氢化物与Y的气态氢化物反应,可生成离子化合物
D.M、N、X、Y均位于金属与非金属的分界线上
3、填空题 氮、磷、锌、铁等是与生命活动密不可分的元素。请回答下列问题:
(1) NH3和PH3都是极性分子,其中极性较大的是______,理由是?。
(2) 20mL0.1 mol·L-1次磷酸(H3PO2)溶液与20 mL 0.1 mol·L-1 NaOH溶液恰好中和生成正盐,则H3PO2的结构式是?。
(3) 下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式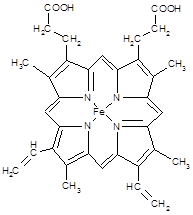 ?
?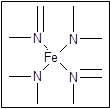
血红素中N原子的杂化方式为?,在右图的方框内用“→”标出Fe2+的配位键。
(4) N2与CO互为等电子体。下表是两者的键能
数据(单位:kJ·mol-1): 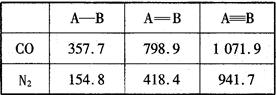
结合数据说明CO比N2活泼的原因:_____。
(5) Zn2+基态时的电子排布式是______,ZnO和ZnS的晶体结构相似,其中熔点较高的是______,理由是?。
4、填空题 已知:A、B、C、D、E、F六种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中最高;F能形成红色(或砖红色)的F2O和黑色的FO两种氧化物。
回答下列问题:
(1)F的原子的M层电子排布式为?。
(2)B、C、D的第一电离能由小到大的顺序为?。(用元素符号表示)
(3)A的简单氢化物分子极易溶于水,其主要原因是?.
(4)E的最高价氧化物分子的空间构型是?。其中心原子的杂化方式为?。
(5)F的高价离子与A的简单氢化物形成的配离子,配位数为?。
(6)A、F形成某种化合物的晶胞结构如图所示,则其化学式为?;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为??g/cm3。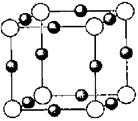
5、选择题 下列分子中,属于含有极性键的非极性分子的是
[? ]