时间:2025-06-25 23:35:18
1、简答题 将28克铁粉溶于4L的某稀硝酸中,二者恰好完全反应,称量反应后的溶液,比反应前增加了16克.
(1)写出可能的化学反应方程式______;.
(2)生成气体的体积为多少L(标准状态时)?
(3)原硝酸的物质的量浓度是多少?
参考答案:(1)铁与稀硝酸可能发生反应:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O、3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,
故答案为:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O、3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O;
(2)由质量守恒可知m(NO)=28g-16g=12g,n(NO)=12g30g/mol=0.4mol,
故NO的体积=0.4mol×22.4L/mol=8.96L,
答:生成气体的体积为8.96L.
(3)n(Fe)=28g56g/mol=0.5mol,如生成Fe(NO3)3,则生成0.5molNO,如生成Fe(NO3)2,则生成0.5mol×23≈0.33mol,则说明生成Fe(NO3)3和Fe(NO3)2,
令Fe(NO3)3和Fe(NO3)2物质的量分别为xmol、ymol,根据Fe元素守恒及电子转移守恒,可得:
本题解析:
本题难度:一般
2、选择题 下列表示物质结构的化学用语或模型中,正确的是
A.HF的电子式:
B.Cl—离子的结构示意图:
C.8个中子的碳原子的核素符号:
D.CH4分子的球棍模型:
参考答案:C
本题解析:A项HF为共价化合物,H和F共用一对电子对,没有电子对的得失A错
B项Cl—原子核内有17个质子,错
C项8个中子的碳原子质量数为8加6(质子数)等于14,C对
D项为CH4分子的比例模型,而不是球棍模型
点评:化学用语的正确使用是学好化学的基础,同时本题也考查了学生的严谨的学习态度,难度不大。
本题难度:简单
3、选择题 下列反应中,电子 转移方向和数目正确的是
转移方向和数目正确的是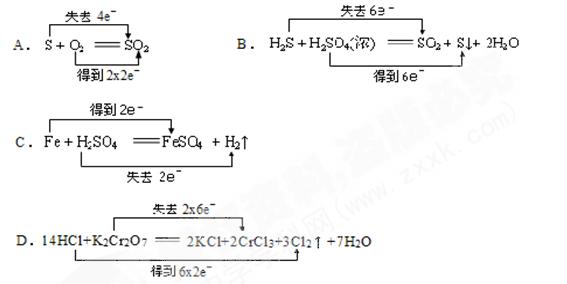
参考答案:A
本题解析:略
本题难度:简单
4、选择题 现将金属镁和铝的混合物7.5g完全溶解于一定浓度足量的硝酸溶液中,收集反应产生的A 气体。向所得溶液中加入过量烧碱溶液,得到沉淀11.6 g。则气体A的成分可能是
A.0.2mol NO和0.1mol NO2
B.0.3 mol NO
C.0.1mol NO、0.2mol NO2和0.1mol N2O4
D.0.3 mol NO2和0.1mol N2O4
参考答案:AC
本题解析:金属镁和铝的混合物与一定浓度足量的硝酸溶液发生反应,形成Mg2+、Al3+,向所得溶液中加入过量的NaOH 溶液,也有Al(OH)3是两性物质,可以与强碱溶液发生反应形成可溶性物质,所以形成沉淀Mg(OH)2,n(Mg(OH)2)= 11.6 g÷58g/mol=0.2mol,则7.5g金属中含有Mg的质量是0.2mol× 24g/mol=4.8g,含有Al质量是2.7g.Al的物质的量是0.1mol。则金属失去电子的物质的量是0.2mol×2 +0.1mol×3=0.7mol。假设反应形成的NO的物质的量是x,形成NO2的物质的量是y,则硝酸转化为气体得到电子的物质的量也应该是0.7mol.A.0.2mol NO和0.1mol NO2得到电子的物质的量是0.2mol×3+ 0.1mol×1=0.7mol,正确;B.0.3 mol NO,得到电子的物质的量是0.3 mol×3=0.9mol>0.7mol,电子转移不守恒,正确;C.形成0.1mol NO、0.2mol NO2和0.1mol N2O4气体,得到电子的物质的量是:0.1mol ×3+ 0.2mol×1+0.1mol×2=0.7mol,正确;D.形成0.3 mol NO2和0.1mol N2O4,硝酸得到电子的物质的量是0.3 mol×1+0.1mol×2=0.5mol<0.7mol,错误。
考点:考查守恒方法在氧化还原反应的计算中的应用的知识。
本题难度:一般
5、填空题 把少量金属钠投入下列溶液中,写出有关反应的化学方程式:
(1)钠投入稀盐酸中______.
(2)钠投入硫酸铜溶液中______.
参考答案:(1)金属钠和酸的反应生成氯化钠和氢气,反应为:2Na+2HCl=2NaCl+H2↑,
故答案为:2Na+2HCl=2NaCl+H2↑;
(2)金属钠和硫酸铜溶液的反应先是和里面的水的反应,生成氢氧化钠和氢气,然后是氢氧化钠和硫酸铜之间的复分解反应,即2Na+2H2O=2NaOH+H2↑,2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,
故答案为:2Na+2H2O=2NaOH+H2↑,2NaOH+CuSO4=Cu(OH)2↓+Na2SO4.
本题解析:
本题难度:一般