时间:2025-06-25 23:35:18
1、填空题 现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。
已知①BrO3-+6I一+6H+=3I2+Br-+3H2O;②2BrO3- +I2 = 2IO3-+ Br2;
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 ,还原产物是 。
(2)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式 。
(3)由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由 。
(4)含6 mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为 。
(5)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。
先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。阳极的电极反应式为 。
参考答案:(1)1:6;KBr
(2)BrO3—+5Br—+6H+=3Br2+3H2O(2分);
(3)不正确,该反应I2作还原剂,Br2还原产物,应得出还原性I2>Br2(合理即可)(2分)
(4)7.2mol(2分);
(5)I—+6OH——6e—=IO3—+3H2O(2分)
本题解析:(1)由图像可知b点时含碘物质的物质的量最低,则证明KI反应完全生成I2,由图可知消耗的氧化剂与还原剂物质的量之比为1:6,还原产物KBr。
(2)b→c过程中含碘物质的物质的量不变,只有一种元素的化合价发生变化只能是Br元素变价,则该过程的离子反应方程式BrO3—+5Br—+6H+=3Br2+3H2O。
(3)在氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,由反应②得出氧化性:
BrO3- >IO3- ;还原性:I2>Br2;
(4)6 molKI的硫酸溶液中加入KBrO3发生的化学反应依次为:
①BrO3-+6I一+6H+=3I2+Br-+3H2O;
BrO3—+5Br—+6H+=3Br2+3H2O。
②2BrO3- +I2 = 2IO3-+ Br2;
可知当I一完全被氧化为IO3-,BrO3-还原为Br2时消耗KBrO3最多为6×6mol/5=7.2mol。
(5)电解目的是制备KIO3,阳极发生氧化反应,则应为I-放电生成IO3—,电极反应式为:
I—+6OH——6e—=IO3—+3H2O。
考点:了解氧化还原反应的本质是电子的转移。了解常见的氧化还原反应。掌握常见氧化还原反应的配平和相关计算。了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。
点评:本题利用图像题的形式考查氧化还原反应的规律及相关计算,熟练掌握氧化还原反应的规律(强弱律、电子守恒律等)的基础上还要注意数形结合,从图中找出重要数据解决问题。
本题难度:困难
2、选择题 下列用来表示物质变化的化学用语中,正确的是
A.NH4NO3溶液呈酸性的原因:NH4++H2O=NH3·H2O+H+
B.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu —2e-= Cu2+
C.硫酸氢钠溶液中滴加少量Ba(OH)2溶液的离子方程式:
2 H++ SO42-+Ba2++2OH-= 2H2O +BaSO4↓
D.如图是在0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl,则 pH=7时的离子方程式:H++HCO3-=CO2↑+ H2O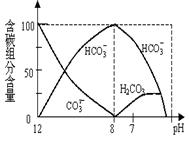
参考答案:C
本题解析:NH4NO3是强酸弱碱,水溶液显酸(盐类水解的特点:有弱就水解;无弱不水解;谁弱谁水解,谁强显谁性;同强显中性;都弱双水解),其水解方程式为:NH4++H2O?NH3·H2O+H+;水解是可逆的,吸热的,平衡的,A错;铜的电解精炼时要求:粗铜作阳极,纯铜作阴极,用硫酸铜溶液(含一定量的硫酸)作电解液,B错;硫酸氢钠是强酸酸式盐,水溶液中的电离方程式为:NaHSO4=Na++H++SO42-;所以与少量的Ba(OH)2溶液的离子方程式为:2 H++ SO42-+Ba2++2OH-= 2H2O +BaSO4↓,遵循少定多变的原则书写,C正确;当pH=7时,溶液中的成分为HCO3-、H2CO3,并没有CO2气体生成,D错。
本题难度:一般
3、选择题 某混合溶液中所含离子的浓度如下表,则M n+离子及a值可能为
| 所含离子 | NO3 |
参考答案:
本题解析:
本题难度:一般
4、简答题 如图是给病人输液用的氯化钠注射溶液的标签.
(1)要配置2000mL这种注射溶液(密度为1g/cm3),需要氯化钠多少克?
(2)某同学为测定该氯化钠注射液是否达标,取该氯化钠注射液130g于烧杯中,然后滴入足量的AgNO3溶液,充分反应后,过滤得到白色沉淀0.02mol.请你通过计算,判断该氯化钠注射液是否符合上述要求.
参考答案:(1)2000ml×1g/cm3×0.9%=18g
或500?ml:4.5g=2000?ml:x?
x=18g,
答:需要氯化钠18g.
(2)n(AgCl)=0.02?mol,
NaCl+AgNO3=AgCl↓+NaNO3
1? ?1
n(NaCl)?0.02?mol
n(NaCl)=0.02?mol?
m?(NaCl)=0.02?mol×58.5g/mol=1.17g
氯化钠的质量分数=1.17g130g×100%=0.9%
答:该氯化钠注射液符合上述要求.
本题解析:
本题难度:一般
5、计算题 (6分)已知反应CuS +4HNO3=Cu(NO3)2 +2NO2↑+S↓+2H2O,当电子转移电子数为1.806×1023时,被还原的硝酸的物质的量是?,氧化产物的质量是?,产生标况NO2的体积为?。
参考答案:? 0.3mol?,? 4.8g?,? 6.72L?
本题解析:略
本题难度:一般