时间:2025-06-25 23:34:30
1、实验题 有下列化学仪器:①托盘天平,②玻璃棒,③药匙,④烧杯,⑤量筒,⑥容量瓶,⑦胶头滴管,⑧漏斗。
(1)现要配制500mL 1mol·L-1的硫酸溶液,需用质量分数为98%、密度为1.84 g·cm-3的浓硫酸__________________mL。
(2)溶液配制过程中需用的到的仪器是______________ (用编号表示)
(3)容量瓶在使用前需要检验_____________。
(4)下列操作对硫酸的物质的量浓度有何影响(填“偏高”、“偏低”、“不变”)。
①摇匀后发现液面低于刻度线再加水:_________
②容量瓶中原有少量蒸馏水:__________
③定容时俯视观察液面:___________
2、选择题 下列溶液中的c(Cl-)与50mL 1mol?L-1氯化铝溶液中的c(Cl-)相等的是( )
A.150mL?1mol?L-1氯化钠溶液
B.75?mL?2mol?L-1氯化铵溶液
C.150?mL?3mol?L-1氯化钾溶液
D.50?mL?1mol?L-1氯化亚铁溶液
3、选择题 20℃时,饱和KCl溶液的密度为1.174g/cm3,物质的量浓度为4.0mol/L,则下列说法中不正确的是
[? ]
A.25℃时,饱和KCl溶液的浓度大于4.0?mol/L
B.此溶液中KCl的质量分数为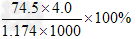 ?
?
C.20℃时,密度小于1.174g/cm3的KCl溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174g/cm3
4、简答题 向100mL?0.1mol/L的AlCl3溶液中滴加NaOH溶液,当滴加碱液800mL时,恰好完全反应得到澄清的溶液,求NaOH溶液的物质的量浓度.
5、选择题 将标准状态下的vL某气体(相对分子质量为M)溶于水中,所得溶液的溶质质量分数为b%.将溶液蒸发掉a&nbrp;得水后(该气体溶质不挥发),所得溶液的溶质质量分数为2b%,密度为ρ得/mL,物质的量浓度为c&nbrp;mol/L.下列关系式不正确的是( )
A.c=
| 1000Vρ 22.4a |
| 20ρb M |
| 50VM 22.4a |
| cM 2000ρ |