时间:2025-06-25 23:34:30
1、实验题 实验室配制500ml 0.1 mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取碳酸钠粉末____________g。
(2)配制时应选用的仪器有500ml容量瓶,托盘天平、烧杯、药匙、___________。
(3)配制时,该实验两次用到玻璃棒,其作用分别是___________、___________。
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
①没有洗涤烧杯和玻璃棒___________。
②如果加水超过了刻度线,取出水使液面恰好到刻度线___________。
③容量瓶没有干燥___________。
2、选择题 向20mL2mol/LAlCl3溶液中,加入30mLNaOH溶液,充分反应后,得0.78g沉淀,则NaOH溶液的物质的量浓度为( )
A.1mol/L
B.2mol/L
C.4mol/L
D.5mol/L
3、选择题 李敏同学欲配制250?mL?1.0?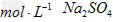 溶液,正确的方法是
溶液,正确的方法是
[? ]
①将35.5?g?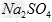 固体溶于250?mL水中?
固体溶于250?mL水中?
②将80.5?g?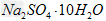 固体溶于少量水中.再用水稀释至250?mL?
固体溶于少量水中.再用水稀释至250?mL?
③将50?mL?5.0?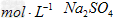 溶液用水稀释至250?mL?
溶液用水稀释至250?mL?
A.①②
B.②③
C.①③
D.①②③?
4、填空题 实验室用固体烧碱配制500mL?1mol/L的NaOH溶液.
(1)需称量______g的烧碱固体,固体应放在______中称量.
(2)配制过程中除了烧杯还需要哪些仪器________________________
(3)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低或无影响)
①定容时俯视刻度线______?②容量瓶未干燥______③转移过程中有少量液体溅出______④未洗涤烧杯和玻璃棒______
(4)若定容时液面高于刻度线应采取的措施是______.
5、选择题 用已准确称量过的氯化钠固体配成100ml1mol/l的氯化钠溶液,需要用到下列仪器中的( )
①坩埚②分液漏斗③100ml容量瓶④烧瓶⑤胶头滴管⑥烧杯⑦玻璃棒⑧托盘天平.
A.③④⑤⑧
B.①②④⑧
C.③⑤⑥⑦
D.①③⑥⑦