时间:2025-06-25 23:33:40
1、填空题 氰(CN)2、硫氰(SCN)2的化学性质和卤素很相似,化学上称为“类卤素”,它们阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-.
试写出:
(1)(CN)2与KOH(aq)反应的化学方程式:______;
(2)NaBr和KSCN的混合溶液中加入足量(CN)2反应的离子方程式:______.
2、选择题 下列离子反应方程式中,正确的是(? )
A.铁与稀硫酸反应 Fe+2H+====Fe3++H2↑
B.二氧化碳与水反应 CO2+H2O====2H++CO32-
C.碳酸钡与盐酸反应 CO32—+2H+====H2O+CO2↑+Ba2+
D.氢氧化钠溶液与硫酸铜溶液反应 2OH—+Cu2+====Cu(OH)2↓
3、选择题 下列说法中正确的是( )
A.用光亮洁净的铁丝蘸取某无色溶液,在无色灯焰上灼烧时观察到黄色火焰,则该溶液中一定含Na+,一定不含K+
B.酸、碱中和反应的实质是H+与OH-?结合生成水,故酸碱中和反应的离子反应都可用:H++OH-═H2O来表示
C.SiC俗称金刚砂,可用作砂纸、砂轮的磨料
D.Na2O与Na2O2都能和水反应生成NaOH,所以它们都是碱性氧化物
4、选择题 下列离子方程式中书写正确的是
[? ]
A.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH-
B.NaHCO3的水解:HCO3-+H2O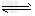 H3O++CO32-?
H3O++CO32-?
C.向醋酸钠溶液中通入少量的二氧化碳:2CH3COO-?+?CO2?+?H2O=2CH3COOH+CO32-?
D.KI溶液与H2SO4酸化的H2O2溶液混合:2?I-?+?H2O2?+?2H+?=2H2O?+?I2?
5、选择题 下列反应的离子方程式书写不正确的是
[? ]
A.少量稀硫酸溶液加入氢氧化钡溶液中:Ba2+ + OH-+ H+ + SO42-=BaSO4↓+H2O
B.向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至SO42-完全沉淀:Al3++ 2SO42-+2Ba2++4OH-=2BaSO4↓
+AlO2-+2H2O
C.碳酸氢钠溶液与少量硫酸氢钠溶液反应:HCO3-+H+=CO2↑+H2O
D.硫酸铝与足量氨水反应:Al3++3NH3·H2O = Al(OH)3↓+ 3NH4+