时间:2025-06-25 23:32:52
1、填空题 某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。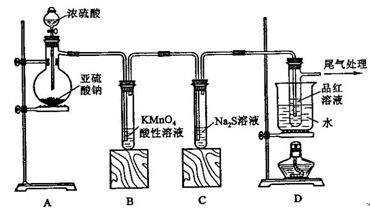
请到答F列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是?,其中发生反应的化学方程式为?;
(2)实验过程中,装置B、C中发生的现象分别是?、?,这些现象分别说明SO2具有的性质是?和?;装置B中发生反应的离子方程式为?;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象?;
(4)尾气可采用?溶液吸收。
参考答案:(1)蒸馏烧瓶? Na2SO3+H2SO4(浓)= Na2SO4+ H2O+SO 2↑
(2)溶液由紫红色变为无色?无色溶液中出现黄色浑浊?
还原性?氧化性? 5SO2 + MnO4- + 2H2O = 2Mn2+ + 5SO42- + 4H+
(3)品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复为红色
(4)NaOH
本题解析:该实验为制备SO2并检验其性质,则A为SO2的发生装置,B、C、D为检验装置;B中为酸性高锰酸钾溶液。它具有强氧化性能把SO2氧化成H2SO4,它本身被还原为Mn2+,溶液的紫色变浅或褪去。故可用于检验SO2的还原性;C中为硫化钠溶液,其具有强还原性二者发生反应产生难溶于水的S单质,看见溶液变浑浊,故可用于检验SO2的氧化性;D中为品红溶液,可检验SO2的漂白性;SO2的漂白是结合漂白,产生的无色物质不稳定,受热容易分解而恢复原来的红色。SO2是大气污染物,它是酸性氧化物,可用碱性溶液NaOH来消除其危害。2的实验室制法及性质的检验。
本题难度:一般
2、选择题 下列叙述正确的是? (? )
A.将二氧化硫气体通入浅黄绿色的氯水中使其颜色褪去,说明二氧化硫具有漂白性
B.SiO2为碳族元素的非金属氧化物,是酸性氧化物,故不能与任何酸发生化学反应
C.用砂纸打磨过的铝箔放在酒精灯焰上不燃烧,说明铝不易与O2反应
D.向装有NaHCO3溶液的两支试管中各滴入CaCl2和MgCl2的饱和溶液,后者有沉淀呈现
参考答案:D
本题解析:A 错误,二氧化硫和氯气发生了氧化还原反应,体现了二氧化硫的还原性
B 错误,SiO2能和HF反应。
C 错误,铝在常温下就可以和O2反应,只是不燃烧罢了。
D 正确。HCO3-和Mg2+发生双水解,生成氢氧化镁沉淀。
本题难度:一般
3、选择题 接触法生产H2SO4的过程中,对废气、废液、废渣和“废热”的处理正确的是?
①尾气用氨水处理?②污水用石灰乳处理
③废渣用来炼铁、制水泥等?④将“废热”通过“废热”锅炉产生蒸气发电
A.只有①②
B.只有①③④
C.只有①②③
D.全部
参考答案:D
本题解析:接触法生产H2SO4的过程中尾气有二氧化硫、三氧化硫等酸性气体,①对,氨水呈碱性,可与其反应生成铵盐;②对,污水含有硫酸,用石灰乳可中和酸性污水;③对,废渣用来炼铁、制水泥等;④对,将“废热”通过“废热”锅炉产生蒸气发电,使能量充分利用;
本题难度:一般
4、选择题 下列褪色过程不是因为氧化还原反应而褪色的是
A.将SO2气体通入到溴水中使溴水褪色
B.将SO2气体通入到KMnO4溶液中使KMnO4,溶液褪色
C.将SO2气体通入到滴有酚酞的NaOH溶液中,溶液褪色
D.将SO2气体通入到氯水中使氯水褪色
参考答案:C
本题解析:SO2具有还原性,溴水具有氧化性二者发生了氧化还原反应才使溴水褪色的,高锰酸钾具有强氧化性,与二氧化硫发生氧化还原反应,高锰酸钾褪色,二氧化硫与氢氧化钠反应生成亚硫酸钠和水,使溶液由碱性变为中性,酚酞发生了变色,这是利用了二氧化硫的酸性;氯水具有强氧化性二氧化硫具有还原性二者发生氧化还原反应使氯水褪色;所以答案选C。
本题难度:简单
5、选择题 二氧化硫可用于工业制硫酸。下列关于二氧化硫的性质描述不正确的是?
A.无色
B.难溶于水
C.密度比空气大
D.有刺激性气味
参考答案:B
本题解析:略
本题难度:简单