时间:2025-06-25 23:32:52
1、实验题 (18分)某同学设计了如下装置用于制取SO2和验证SO2的性质。分流漏斗内装75%的浓硫酸,锥形瓶内装固体Na2SO3。试回答以下问题: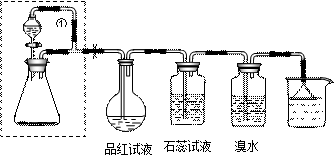
⑴锥形瓶内发生的反应的化学方程式为:?。
⑵实验过程中,品红试液的颜色变为:?;石蕊试液的颜色变化为:?。实验后加热烧瓶,品红试液的颜色变化为:?。
⑶溴水与SO2反应的离子方程式为:?。
⑷导管①的作用是:?;倒置漏斗的作用是?。
⑸方框内装置能否换成启普发生器??(回答“能”或“不能”)。
2、实验题 为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验Ⅰ 反应产物的定性探究
实验装置如图所示。(固定装置已略去)
(1)A中反应的化学方程式为?。
(2)F烧杯中的溶液通常是?。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是?。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是?。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为?。
实验Ⅱ 反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1:
| 硫酸/mol·L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
3、选择题 已知0.1mol某单质与足量的硫在一定条件下充分反应后,质量增加了1.6g,则该单质可能是(? )
A.钙
B.铜
C.铁
D.铝
4、选择题 用如图所示实验装置进行物质性质的探究实验。下列说法不合理的是(?)
A.若品红溶液①褪色,则说明产物中含有SO2
B.若溴水褪色,则说明SO2具有还原性
C.若烧瓶中产生黄色浑浊和无色气泡,则说明Na2S2O3只作氧化剂
D.若品红溶液②不褪色、Na2SiO3溶液中出现白色浑浊,则说明亚硫酸比碳酸的酸性强
5、实验题 某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象。经过思考分析,该同学改用图二的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快。 ?
?
(1)若锥形瓶内装的是亚硫酸钠,写出锥形瓶内反应的化学方程式:_______________________________。
(2)对比分析两组实验,你认为用图一装置实验时,通入SO2不能出现浑浊的原因可能是_________________。写出此时试管内发生反应的总化学方程式:_____________________。
(3)用图二装置实验时,以相同速率通入CO2或SO2,SO2产生浑浊再变澄清的现象比CO2快,其原因是____________________________________。
(4)用图一进行SO2与石灰水反应的实验时,为防止SO2污染空气,应用盛有过量浓烧碱溶液的容器吸收SO2,写出容器内发生反应的离子方程式:?。