时间:2025-06-25 23:31:59
1、选择题 下列反应不能用离子方程式H++ OH-= H2O表示的是(?)
A.硝酸与Ba(OH)2溶液
B.澄清石灰水与盐酸
C.NaOH与NaHSO4溶液
D.硫酸与Ba(OH)2溶液
2、选择题 下列离子方程式正确的是
[? ]
A.铁与稀反应:Fe+2H+==Fe2++H2↑
B.小苏打与氢氧化钠溶液混合:HCO3-+OH-==H2O+CO32-
C.氯化钙与碳酸氢钾溶液混合:Ca2++CO32-==CaCO3↓
D.CuSO4溶液与Ba(OH)2溶液混合:Cu2++SO42-+Ba2++2OH-==Cu(OH)2↓+BaSO4↓
3、选择题 下列离子方程式书写正确的是
[? ]
A.用氨水吸收少量SO2:NH3·H2O+SO2=NH4++HSO3-
B.碳酸钡溶于醋酸:BaCO3+2H+=Ba2+ +H2O+CO2↑
C.FeS与盐酸反应:FeS+2H+==Fe2+ +H2S↑
D.大理石与稀盐酸反应:CO32-+2H+==CO2↑+H2O
4、选择题 下列离子方程式中正确的是
[? ]
A.过量的NaHSO4与Ba(OH)2溶液反应 Ba2++2OH-+2H++SO42- =BaSO4↓+2H2O
B.NH4HCO3溶液与过量的NaOH溶液反应 NH4++OH-=NH3·H2O
C.NaHCO3溶液中加过量的澄清的石灰水 2HCO3-+2OH-+Ca2+=CaCO3↓+CO32-+2H2O
D.CaCO3跟CH3COOH反应 CaCO3+2H+=Ca2++H2O+CO2↑
5、填空题 某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下: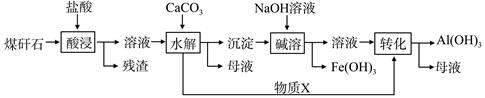
(1)“酸浸”过程中主要反应的离子方程式为_____________、_________________。
(2)“酸浸”时铝浸出率的影响因素可能有_____________、___________。(写出两个)
(3)物质X的化学式为___________。“碱溶”时反应的离子方程式为____________。
(4)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。为了获得产品Al(OH) 3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是____________________。
(5)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3溶液中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因:_______________________。