时间:2025-06-25 23:31:59
1、选择题 下列离子方程式书写正确的是
A.氨水吸收少量的二氧化硫:NH3·H2O + SO2 = NH4+ + HSO3-
B.用两个铜片作电极电解盐酸:Cu + 2H+  H2↑+ Cu2+
H2↑+ Cu2+
C.钠与水反应:Na +2H2O = Na+ +2OH- +H2↑
D.铜与稀硝酸反应:3Cu +8H+ + 2NO3- = 3Cu2+ +2NO↑ +4H2O
参考答案:BD
本题解析:过量二氧化硫和氨水反应才生成亚硫酸氢铵,A错误;C选项,未配平,电荷不守恒,错误。
本题难度:一般
2、选择题 下列离子方程式正确的是(?)
A.向盐酸中滴加氨水:H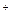 +OH
+OH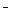 ==H2O
==H2O
B.向次氯酸钙溶液中通入少量的CO2:
Ca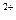 +2ClO
+2ClO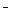 +H2O+CO2 ="==" CaCO3
+H2O+CO2 ="==" CaCO3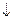 +2HClO
+2HClO
C.将少量Cl2通入KBr、KI的混合溶液中
Cl2+2Br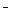 ==Br2+2Cl
==Br2+2Cl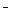
D.利用腐蚀法制作印刷线路板:Fe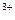 +Cu==Fe
+Cu==Fe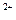 +Cu
+Cu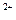
参考答案:B
本题解析:略
本题难度:一般
3、选择题 下列离子方程式正确的是( )
A.碳酸钙加入稀盐酸中:CO32-+H+═H2O+CO2↑
B.硫酸铜溶液与氢氧化钡溶液混合:Ba2++20H-+SO42-+Cu2+═BaSO4↓+Cu(OH)2+
C.硝酸银溶液中加入铜粉:Ag++Cu═Ag+Cu2+
D.铁粉加入稀盐酸中:2Fe+6H+═3H2↑+2Fe3+
参考答案:A、A、碳酸钙不溶于水,离子方程式中应写成化学式,正确的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,故A错误;
B、两组离子反应,生成难溶物,相关离子要符合组成比,正确的离子方程式为Ba2++20H-+SO42-+Cu2+═BaSO4↓+Cu(OH)2↓,故B正确;
C、电子得失不守恒,离子方程式为2Ag++Cu═2Ag+Cu2+,故C错误;
D、氢离子是弱氧化剂,只能将铁氧化为亚铁离子,正确的离子方程式为Fe+2H+═H2↑+Fe2+,故D错误;
故选B.
本题解析:
本题难度:简单
4、填空题 (14分)Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第?周期第?族;S的基态原子核外有?个未成对电子;Si的基态原子核外电子排布式为?。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si?S | O2-?Na+ | NaCl?Si | H2SO4 ?HClO4 |
参考答案:
(1)第三周期,第ⅠA族? 2,1s22s22p63s23p2
(2)<,>,<,<,
(3)4CuCl(s)+O2(g)=2CuCl2(2)+2CuO(s)?△H=-177.6kJ/mol
(4)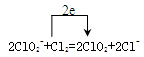
本题解析:(1)S的最外层有6个电子,为3s23p4,3p能级三个轨道、四个电子,依据泡利原理和洪特规则,先每个轨道排1个,方向相同,排满后再排,方向相反,故有两个孤对电子;硅,核电核数为14,根据构造原理可以排出。
(2)第一电离能同周期从左往右逐渐增大趋势,但有几个反常,故有Si<S;具有相同的电子层结构,核电荷越多半径越小,故有O2-<Na+;一般熔沸点原子晶体大于离子晶体;同周期从左到右非金属性逐渐增强,非金属性越强其最高价氧化物对应水化物的酸性越强。
(3)该反应为氧化还原反应,Cu从+1到+2价,O2做氧化剂,从0价到-2价。
(4)氯气做氧化剂从0价到-1价,亚氯酸根从+3到+4价。
本题难度:一般
5、选择题 下列离子方程式书写正确的是( )
A.铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑
B.AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓
C.三氯化铁溶液中加入铁粉Fe3++Fe=2Fe2+
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
参考答案:A、铝粉投入到NaOH溶液中产生氢气,反应实质为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
B、氨水是弱电解质,不能拆成离子形式,应改为:Al3++3NH3?H2O═Al(OH)3↓+3NH4+,故B错误;
C、三氯化铁溶液中加入铁粉的反应为:2Fe3++Fe=3Fe2+,故C错误;
D、氯气能加亚铁离子氧化到最高价,即2Fe2++Cl2=2Fe3++2Cl-,故D正确.
故选D.
本题解析:
本题难度:一般