时间:2025-06-25 23:30:23
1、选择题 下列电离方程式错误的是
[? ]
A. NaHCO3=Na+ +H+ +CO32-
B. NaHSO4=Na+ +H+ +SO42-
C. MgCl2=Mg2+ +2Cl-
D. Ba(OH)2=Ba2+ +2OH-
参考答案:A
本题解析:
本题难度:简单
2、选择题 下列有关说法正确的是
A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0
B.醋酸钠溶液中滴加酚酞显红色,证明醋酸为弱电解质
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
D.某温度下,纯水中的c(H+)=1.0×10-6.5mol/L,则该温度下pH=1的盐酸中水电离的c(H+)=1.0×10-12mol/L
参考答案:BD
本题解析:A.CaCO3(s)=CaO(s)+CO2(g)是体系混乱程度增大的反应,在室温下不能自发进行,说明该反应的△H>0,错误;B.醋酸钠是盐,在其溶液中滴加酚酞显红色,证明醋酸钠是强碱弱酸盐,弱酸根离子发生水解反应消耗水电离产生的c(H+),是溶液中c(OH-)> c(H+),所以醋酸为弱电解质,正确;C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)加快;升高温度,根据平衡移动原理,平衡向吸热的方向移动,对该反应来说,平衡逆向移动,所以氢气的平衡转化率减小,错误;D.某温度下,纯水中的c(H+)=1.0×10-6.5mol/L,Kw=1.0×10-13mol2/L2,所以温度高于室温。则该温度下pH=1的盐酸中水电离的c(H+)= c(OH-)=1.0×10-13mol2/L2÷1.0×10-1mol/L=1.0×10-12mol/L,错误。
2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)加快;升高温度,根据平衡移动原理,平衡向吸热的方向移动,对该反应来说,平衡逆向移动,所以氢气的平衡转化率减小,错误;D.某温度下,纯水中的c(H+)=1.0×10-6.5mol/L,Kw=1.0×10-13mol2/L2,所以温度高于室温。则该温度下pH=1的盐酸中水电离的c(H+)= c(OH-)=1.0×10-13mol2/L2÷1.0×10-1mol/L=1.0×10-12mol/L,错误。
考点:考查反应的自发性、盐的水解、化学平衡及弱电解质的电离的知识。
本题难度:一般
3、选择题 用水稀释0.1 mol·L-1氨水时,溶液中随水量的增加而减小的是 ( )。
A.c(OH-)/c(NH3·H2O)
B.c(NH3·H2O)/c(OH-)
C.n(OH-)和c(H+)
D.c(H+)和c(OH-)的乘积
参考答案:B
本题解析:加水促进NH3·H2O的电离,使n(NH3·H2O)减小,n(OH-)增大,c(OH-)减小,但c(H+)和c(OH-)的乘积即KW不变,则c(H+)增大。因此c(NH3·H2O)/c(OH-)=n(NH3·H2O)/n(OH-)减小。
本题难度:一般
4、选择题 对于常温下PH为2的盐酸,叙述正确的是
A.c(H+) = c(Cl—) + c(OH—)
B.由H2O电离出的c(H+) =" 1.0" ×10—12 mol·L—1
C.与等体积PH=12的氨水混合后所得溶液显酸性
D.与等体积0.01 mol·L—1乙酸钠溶液混合后所得溶液中:c(Cl—) = c(CH3COO—)
参考答案:AB
本题解析:A、由电荷守恒可知:c(H+) = c(Cl—) + c(OH—),正确;B、因为盐酸的PH为2,所以溶液中氢氧根离子的浓度为10—12 mol·L—1,而氢氧根离子完全是由于水电离子而生成的,因此由H2O电离出的c(H+) =" 1.0" ×10—12 mol·L—1,正确;C、与等体积PH=12的氨水混合后所得溶液显大碱性,错误;D、因为醋酸根离子要水解,因此有c(Cl—) >c(CH3COO—),错误。
考点:考查溶液中离子关系。
本题难度:一般
5、选择题 常温下把pH=11的NaOH溶液加水稀释到原浓度的一半,溶液的pH为
(注:lg2=0.3 lg3=0.48 lg5=0.7)
A.11
B.5.5
C.11.3
D.10.7
参考答案:D
本题解析:把pH=11的NaOH溶液中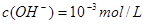 ,加水稀释到原浓度的一半即
,加水稀释到原浓度的一半即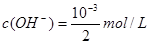 ,即
,即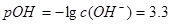 ,所以得
,所以得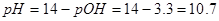
本题难度:一般