时间:2025-06-25 23:30:23
1、填空题 (14分)一定温度下,有a、盐酸;b、硫酸;c、醋酸三种酸的稀溶液。(用a、b、c、<、=、>号填写)
①当其物质的量浓度相同时,c(H+)由大到小的顺序是_______________ ____,
②同体积同物质的量浓度的三种酸,中和NaOH能力的顺序是_________ ________,
③当其c(H+)相同时,物质的量浓度由大到小的顺序为________________ _____,
④当c(H+)相同、体积相同时,分别加入足量锌,相同状况产生的气体体积由大到小的顺序为__________________ ___。
⑤当pH相同、体积相同时,同时加入锌,若产生相同体积的氢气(相同状况)则开始时反应速率__________________,反应所需的时间__________ _____ ____。
⑥将c(H+)相同的三种酸均稀释10倍,pH由大到小的顺序为_____________ _______。
参考答案:①b>a>c,②b>a=c,③c.>a>.b,④c>a=b。⑤a=b=c,a=b>c。⑥a=b>c。
本题解析:①氯化氢和硫酸是强电解质,在水中完全电离,盐酸是一元酸,所以盐酸中c(H+)=c(HCl),硫酸是二元酸,硫酸溶液中c(H+)=2c(H2SO4),醋酸是一元弱酸,所以醋酸溶液中c(H+)<c(CH3COOH),所以等物质的量浓度的三种酸,氢离子浓度大小顺序是b>a>c,故答案为:b>a>c;②同体积同物质的量浓度的三种酸,三种酸n(HCl)=n(CH3COOH)=n(H2SO4),盐酸和醋酸是一元酸,硫酸是二元酸,盐酸和醋酸需要氢氧化钠的物质的量相等,硫酸需要的氢氧化钠是盐酸和醋酸的2倍,中和NaOH能力由大到小的顺序是b>a=c,故答案为b>a=c;③氯化氢和硫酸是强电解质,盐酸是一元酸,硫酸是二元酸,醋酸是弱电解质且是一元酸,所以盐酸中氢离子浓度与酸的浓度相等,硫酸中氢离子浓度是硫酸的浓度的2倍,醋酸中氢离子浓度小于醋酸的浓度,所以如果氢离子浓度相等时,物质的量浓度由大到小的顺序为c>a>b,故答案为:c>a>b;④氢离子浓度相同时,盐酸和硫酸是强电解质,氢离子的物质的量相等,生成氢气的量相同,醋酸是弱电解质,醋酸的物质的量远远大于盐酸和硫酸的物质的量,故生成气体的量为c>a=b;⑤与锌反应时产生氢(气)的速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大,当c(H+)相同、体积相同时,同时加入形状、质量、密度相同的锌,则开始时反应速率的大小关系是a=b=c,随着反应的进行,醋酸是弱电解质,仍源源不断的电离出氢离子,氢离子浓度大于盐酸和硫酸中氢离子浓度,反应速率快,所需时间短,故答案为a=b=c,a=b>c;⑤强酸溶液稀释10倍,氢离子浓度变为原来的1/10,弱酸溶液稀释10倍,氢离子浓度变为大于原来的1/10,盐酸和硫酸是强酸,醋酸是弱酸,所以c(H+)由大到小的顺序为a=b>c,故答案为a=b>c.
考点:弱电解质在水中的电离平衡
本题难度:一般
2、选择题 水的电离平衡曲线如图所示,下列说法不正确的是
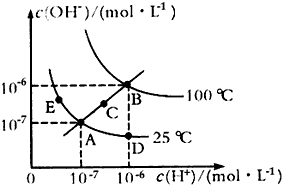
[? ]
参考答案:C
本题解析:
本题难度:一般
3、填空题 (18分)(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡向________(填“正”或“逆”)向移动;溶液中 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3 CH3COONa+CO2↑+H2O。
CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
(3)99 ℃时,Kw=1.0×10-12,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为_____________________________。
②该温度下,将0.01 mol·L-1 H2A溶液稀释到20倍后,溶液的pH=________。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气_____。
A.盐酸多
B.H2A多
C.一样多
D.无法确定
④将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为_______________________________________。
参考答案:(1)逆 不变
(2)中 碱 NH4+
(3)①H2A 2H++A2-②3 ③C ④c(NH4+)>c(A2-)>c(H+)>c(OH-)
2H++A2-②3 ③C ④c(NH4+)>c(A2-)>c(H+)>c(OH-)
本题解析:(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,因为醋酸溶液中存在CH3COOH H++CH3COO-,则醋酸根离子浓度增大,平衡逆向移动;
H++CH3COO-,则醋酸根离子浓度增大,平衡逆向移动; 即为醋酸的电离常数,因为温度不变,所以电离常数不变;
即为醋酸的电离常数,因为温度不变,所以电离常数不变;
(2)醋酸与NH3·H2O的电离平衡常数相同,则铵根离子与醋酸根离子的水解程度相同,所以溶液呈中性;醋酸的酸性比碳酸强,所以碳酸氢根离子的水解程度大于醋酸根离子的水解程度也大于铵根离子的水解程度,碳酸氢根离子的水解使溶液呈碱性,所以碳酸氢铵溶液呈碱性;则NH4HCO3溶液中物质的量浓度最大的离子是NH4+;
(3)①99 ℃时,Kw=1.0×10-12,c(H+)=c(OH-)=10-6mol/L,因此pH=6的溶液为中性。则该温度下测得0.1 mol·L-1 Na2A溶液的pH=6,所以H2A为二元强酸,完全电离,电离方程式为H2A 2H++A2-;
2H++A2-;
②该温度下,0.01 mol·L-1 H2A溶液中氢离子的物质的量浓度是0.02mol/L,稀释到20倍后,氢离子浓度变为0.02mol/L/20=0.001mol/L,溶液的pH=-lg0.001=3;
③体积相等、pH=1的盐酸与H2A溶液中氢离子的物质的量相等,则与足量的Zn反应时产生的氢气一样多,答案选C;
④将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,二者恰好完全反应生成(NH4)2A和水,铵根离子水解使溶液呈酸性,所以溶液中离子浓度的大小关系是c(NH4+)>c(A2-)>c(H+)>c(OH-)。
考点:考查电解质的电离平衡移动的判断,电离常数的判断,离子浓度的比较,电解质强弱的判断,盐的水解程度的比较,溶液酸碱性的判断
本题难度:困难
4、填空题 (10分)实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下
实验。请你完成下列填空:
步骤一:配制100mL 0.10mol/L NaOH标准溶液。.
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.02 | 20.00 |
| 2 | 0.10 | 22.00 | 20.00 |
| 3 | 0.10 | 21.98 | 20.00 |

参考答案:(1)最后一滴NaOH溶液加入时,溶液颜色恰好由无色变为浅红色,且半分钟内不褪色 8.2—10
(2)0.11mol/L (3)丙 (4)A、D、E。
本题解析:(1)由于指示剂在未知浓度的酸溶液中,开始是无色的,所以滴定达到终点的现象是溶液由无色变为浅红色,半分钟内不褪色。此时锥形瓶内酚酞溶液的pH的范围是8.2—10。(2)V(NaOH)=22.00ml,由于酸碱恰好反应时的关系是:V(NaOH)·C(NaOH)= V(HCl)·C(HCl),所以C(HCl)="[" V(NaOH)·C(NaOH)] ÷V(HCl)="22.00ml×0.10mol/L÷20.00ml=0.11mol/L;" (3)排去碱式滴定管中气泡的方法应采用右图的丙装置操作;(4)A. 配制标准溶液定容时,加水超过刻度,则标准溶液的浓度偏小,消耗的标准溶液体积偏大,所以使测定的待测溶液的浓度偏大;正确;B. 锥形瓶水洗后直接装待测液,由于碱液的物质的量不变,所以消耗标准溶液的体积不变,故无影响,错误;C. 酸式滴定管水洗后未用待测稀盐酸溶液润洗,则在锥形瓶中的待测溶液的物质的量偏少,消耗的标准溶液体积偏小,因此计算出的浓度就偏低,错误;D. 滴定到达终点时,仰视读出滴定管读数;则标准溶液的体积偏大,使待测溶液的浓度偏大,正确;E. 碱式滴定管尖嘴部分有气泡,滴定后消失,则标准溶液的体积偏大,所以使待测溶液的浓度就偏大,正确。
考点:考查酸碱中和滴定的终点的判断、误差分析及浓度的计算的知识。
本题难度:一般
5、填空题 (1)某温度下,纯水的[H+] =2.0×l0-7mol·L—l,则此时的[OH—]=__________。若温度不变,滴入稀硫酸使[H+] =5.0×l0-7mol·L—l.则[OH—]=_________,由水电离出的[H+]=__________。
(2)若l00℃时纯水电离出的[H+]为l.0×l0-6mol·L—l,此时Kw=__________。
参考答案:(1)2.0×10-7mol·L-1,8.0×10-8mol·L-1,8.0×10-8mol·L-1、(2)1.0×10-12
本题解析:(1)H2O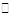 H++OH-,水电离出的c(H+)=c(OH-),则此时纯水中c(OH-)=2.0×10-7mol·L-1,此温度下的Kw=c(H+)×c(OH-)=2.0×10-7×2.0×10-7=4.0×10-14,温度不变,滴入稀硫酸,Kw不变,c(OH-)=
H++OH-,水电离出的c(H+)=c(OH-),则此时纯水中c(OH-)=2.0×10-7mol·L-1,此温度下的Kw=c(H+)×c(OH-)=2.0×10-7×2.0×10-7=4.0×10-14,温度不变,滴入稀硫酸,Kw不变,c(OH-)=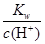 =
=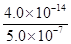 =8.0×10-8mol·L-1,酸性溶液中的OH-是由水电离产生的,且水电离产生H+和OH-的量相等,因此此溶液中水电离出的c(H+)=8.0×10-8mol·L-1;(2)水电离出c(H+)=c(OH-),Kw=c(H+)×c(OH-)=c2(H+)=1.0×10-12。
=8.0×10-8mol·L-1,酸性溶液中的OH-是由水电离产生的,且水电离产生H+和OH-的量相等,因此此溶液中水电离出的c(H+)=8.0×10-8mol·L-1;(2)水电离出c(H+)=c(OH-),Kw=c(H+)×c(OH-)=c2(H+)=1.0×10-12。
考点:考查水的电离和水的离子积等相关知识。
本题难度:一般