时间:2025-06-25 23:26:18
1、填空题 (4分)用质量分数为98%、密度为1.84g·cm-3的浓硫酸配制100mL 1.84mol·L-1的稀硫酸,若实验仪器有:
A.100mL量筒;
B.托盘天平;
C.玻璃棒;
D.50mL容量瓶;
E.10mL量筒,F.胶头滴管;G.50mL烧杯;H.100mL容量瓶
实验时应选用仪器的先后顺序是(填入编号):_______________________________。
参考答案:EFGCHF (4分)
本题解析:需要浓硫酸的体积是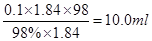 ,所以需要10ml量筒,量取时还需要胶头滴管。浓硫酸的稀释需要烧杯玻璃棒,转移到100ml容量瓶中,而定容时还需要胶头滴管,所以实验时应选用仪器的先后顺序是EFGCHF。
,所以需要10ml量筒,量取时还需要胶头滴管。浓硫酸的稀释需要烧杯玻璃棒,转移到100ml容量瓶中,而定容时还需要胶头滴管,所以实验时应选用仪器的先后顺序是EFGCHF。
考点:考查一定物质的量浓度溶液的配制
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,所以要求学生必须熟练掌握。
本题难度:一般
2、选择题 设NA为阿伏加德罗常数的值。下列叙述正确的是? ( )。
A.25 ℃,1 L pH=1的稀硫酸中含有的H+数为0.1 NA
B.标准状况下,224 mL水含有的电子数为0.1 NA
C.常温常压下,0.56 L甲烷中含有的共价健数为0.1 NA
D.0.15 mol NO2与水完全反应时转移的电子数为0.15 mol NA
参考答案:A
本题解析:本题考查气体摩尔体积概念、pH计算及反应中电子转移情况。虽然H2SO4是二元酸,但c(H+)=0.1 mol·L-1,体积为1 L,N(H+)=0.1 NA,A正确;224 mL水的物质的量远大于0.01 mol,电子数远大于0.1 NA,B项错;常温常压下,0.56 L CH4的物质的量小于0.025 mol,含有的共价键数小于0.1 NA,C项错。由方程式3NO2+H2O=2HNO3+NO可知0.15 mol NO2与水完全反应时转移电子数为0.1 mol,D错误。
本题难度:一般
3、选择题 下列有关阿伏加德罗常数说法正确的是(NA表示阿伏加德罗常数的值)
A.常温常压下,18g NH4+所含的电子数为10NA
B.56g金属铁与氯气反应时得到的电子数为3NA
C.标准状态下,22.4L氧气所含的氧原子数为2 NA
D.4.48 L H2和O2的混合气体中所含分子数约为0.2 NA
参考答案:AC
本题解析:18g NH4+物质的量为1mol,18g NH4+中有10个电子,电子的物质的量为10mol,个数为10NA,A对;金属铁与氯气反应时铁做还原剂,失去电子,B错;标准状态下,22.4L氧气的物质的量为1mol,氧原子的物质的量为2mol,个数为2 NA,C对;D中没有标准状况条件无法计算,选AC。
考点:阿佛加德罗常数的有关计算。
本题难度:一般
4、选择题 下列溶液中溶质的物质的量浓度是1mol/L的是
A.将40g NaOH溶解于1L水中
B.将22.4LHCl气体溶于水中配成1L溶液
C.将1L 10mol/L 的浓盐酸与9L水混合
D.将10g NaOH溶于水中配成250mL溶液
参考答案:D
本题解析: 1mol/L表示1升的溶液中所含溶质的物质的量为1mol。所以答案选D
考点:考查物质的量浓度的相关知识点。
本题难度:一般
5、填空题 现有4.0gNaA,其中含6.02×1022个Na+。(A表示原子或原子团)
(1)NaA的相对分子质量为__________。
(2)将此NaA完全溶解在46.0g水中,所得溶液的质量分数为_____________。
(3)若上述溶液的密度近似为1.0g/cm3,则该溶液的物质的量浓度为______________。
参考答案:(1)40
(2)8%
(3)2mol/L
本题解析:
本题难度:一般