时间:2025-06-25 23:19:47
1、简答题 (14分)
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含氰废水中的CN-有剧毒。
①CN-中C元素显+2价, N元素显-3价,用原子结构解释N元素显负价的原因是?,共用电子对偏向N原子,N元素显负价。
②在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为?。
(2)含乙酸钠和对氯酚( )的废水可以利用微生物电池除去,其原理如下图所示。
)的废水可以利用微生物电池除去,其原理如下图所示。
①B是电池的?极(填“正”或“负”);②A极的电极反应式为?。
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A- 表示乳酸根离子)。
①阳极的电极反应式为?。
②简述浓缩室中得到浓乳酸的原理:?。
③ 电解过程中,采取一定的措施可控制阳极室的pH约为6-8,此时进入浓缩室的OH-可忽略不计。400mL 10 g?L-1乳酸溶液通电一段时间后,浓度上升为145 g?L-1(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为?L。(乳酸的摩尔质量为90 g? mol-1)
2、填空题 如图所示,装置B部分盛有1 L?2 mol/L Na2SO4溶液,装置A部分盛有1 L?2 mol/L?AgNO3溶液。通电后,湿润的KI淀粉试纸的C端变蓝色,试回答下列问题: ?
?
⑴A中发生反应的化学方程式为?。
⑵在B中观察到的现象是?。
⑶室温下,若从电解开始到时间为T时,A、B装置中共收集到气体0.168L(标准状况),若电解过程中无其它副反应发生,且溶液体积变化忽略不计,则在时间T时,A溶液的c(H+)为?。
3、简答题 甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:
(1)若两池中均盛放100ml0.1mol/LCuSO4溶液,反应一段时间后:
①当电路中通过0.01电子时,甲池中的______棒上析出Cu,其质量为______g.
②在乙池中阳极的电极反应式是______.
(2)若两池中均盛放100ml0.1mol/LNaCl溶液.
①写出甲池中正极的电极反应式______
②写出乙池中总反应的离子方程式______
③当电路通过0.01mol电子时,不考虑溶液体积变化,常温下乙池溶液的pH=______.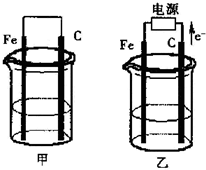
4、选择题 下列装置能构成电解池的是(烧杯中盛有相应的溶液)() ?
?
5、选择题 用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入 0.1molCu(OH)2后恰好恢复到电解前的浓度和PH。则电解过程中转移的电子数为( )
A.0.1mol
B.0.2mol
C.0.3mol
D.0.4mol