时间:2025-06-25 23:02:38
1、选择题 现有KCl和KBr的混合物3.87 g,将混合物全部溶于水,并加入过量的AgNO3溶液,充分反应后产生6.63 g沉淀物,则原混合物中钾元素的质量分数为(?)
A.24.1%
B.25.9%
C.40.3%
D.48.1%
参考答案:C
本题解析:从KX AgX可认为1 mol K+被1 mol Ag+取代。
AgX可认为1 mol K+被1 mol Ag+取代。
根据差量法:KX—AgX?Δm
1 mol? 69 g
n(K+)? 2.76 g
故n(K+)=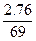 mol="0.04" mol
mol="0.04" mol
故m(K+)="39" g·mol-1×0.04 mol="1.56" g
w(K+)=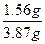 ×100%=40.3%
×100%=40.3%
本题难度:简单
2、简答题 在新制氯水中存在的各种粒子中:(用化学式或离子符号填写);
(1)使氯水呈黄绿色的是______(2)能使硝酸银溶液产生白色沉淀的是______;
(3)能使紫色石蕊试液显红色的是______;(4)能使湿润的红纸褪色的是______;
(5)能使无水硫酸铜变蓝的是______;(6)能与碳酸氢钠溶液反应放出气体的是______.
参考答案:氯水中存在的分子有H2O、Cl2、HClO等,存在的离子有:H+、Cl-、OH-、ClO-等.
(1)使氯水呈黄绿色的是Cl2,故答案为:Cl2;
(2)能使硝酸银溶液产生白色沉淀的是Cl-,故答案为:Cl-;
(3)能使紫色石蕊试液显红色的是H+,故答案为:H+;
(4)能使湿润的红纸褪色的是HClO,故答案为:HClO;
(5)能使无水硫酸铜变蓝的是H2O,故答案为:H2O;
(6)能与碳酸氢钠溶液反应放出气体的是H+,故答案为:H+.
本题解析:
本题难度:一般
3、填空题 二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂。
(1)氯化钠电解法是一种可靠的工业生产ClO2方法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。其次除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,其原因是___________【已知:Ksp(BaSO4)= 1.1 ×10-10 Ksp(BaCO3)= 5.1 ×10-9】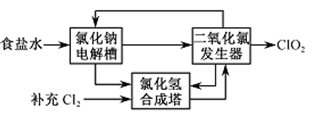
②该法工艺原理如右。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。
工艺中可以利用的单质有____________(填化学式),发生器中生成ClO2的化学方程式为___________。
(2)纤维素还原法制ClO2是一种新方法,其原理是:纤维素水解得到的最终产物D与NaClO3反应生成ClO2。完成反应的化学方程式:
□?(D)?+24NaClO3+12H2SO4=□ClO2↑+□CO2↑+18H2O+□_________
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-。处理含CN-相同量得电镀废水,所需Cl2的物质的量是ClO2的_______倍
参考答案:
(1)①BaCl2
BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO32-时,BaSO4(s)会部分转化为BaCO3(s)(或其它合理答案)
②H2、Cl2
2NaClO3 + 4HCl  ?2ClO2↑ + Cl2↑ + 2NaCl + 2H2O
?2ClO2↑ + Cl2↑ + 2NaCl + 2H2O
(2)1C6H12O6+ 24 NaClO3 + 12H2SO4 24 ClO2↑ + 6 CO2↑ + 18H2O + 12 Na2SO4
24 ClO2↑ + 6 CO2↑ + 18H2O + 12 Na2SO4
(3)2.5
本题解析:
(1)①在除杂的过程中每步加入的试剂必须是过量的,使离子除尽;过量的离子在下一步中必须出去,故先加入BaCl2,除去硫酸根,过量的钡离子,加入Na2CO3除去。根据提供的Ksp数据,在后面加入碳酸钠时,发生BaSO4(s)+ CO32- (aq)= BaCO3(s)+SO42- (aq)。②电解饱和食盐水生成H2、Cl2和NaOH;故可以利用的单质为H2、Cl2,合成HCl。根据流程图可知加入物质为NaClO3和HCl,生成ClO2;可以写出方程式,并用化合价升降法配平得到。
(2)纤维素为多糖,水解最终产物为葡萄糖(C6H12O6),具有还原性,可将NaClO3还原得到ClO2。Cl从+5到+4价,降低1价,葡萄糖(C6H12O6)C均价为0,到+4价,升高4价,然后配平得到。
(3)每摩尔Cl2得到2mol电子,而没摩尔ClO2得到5mol电子,故为2.5倍。
【考点定位】考查化学工艺流程,涉及氧化还原反应相关概念、配平及计算,化学实验基本方法(除杂)等相关知识。
本题难度:一般
4、选择题 氯气可用于杀菌和消毒,这是因为( )
A.氯气有毒,可毒死病菌
B.氯气与水反应生成具有强氧化性的HClO
C.氯气具有漂白作用
D.氯气与水反应生成的盐酸是强酸
参考答案:A、氯气有毒,对人和牲畜、动物等都有害,故A错误;
B、氯气与水可以反应生成具有强氧化性的HClO,次氯酸具有杀菌消毒作用,故B正确;
C、氯气没有漂白性,故C错误;
D、氯气与水反应生成盐酸和次氯酸,盐酸无杀菌消毒作用,但是次氯酸具有该性质,故D错误.
故选B.
本题解析:
本题难度:简单
5、实验题 (14分)从固体混合物A出发可以发生如下框图所示的一系列变化.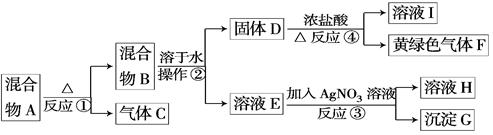
G为不溶于稀硝酸的白色固体;溶液H的焰色反应呈紫色(透过蓝色的钴玻璃观察).
回答下列问题:
(1)在实验室中收集气体C,可选择下图装置中的____?____.
(2)操作②的名称是___?___.在操作②中所使用的玻璃仪器 的名称是_____?.
的名称是_____?.
(3)写出反应④的离子方程式: _______________?_________________________。
(4)在实验室中,要获得干燥纯净的黄绿色气体F,可以将它通过如图中的装置,其中瓶Ⅰ中盛放的是______? ?___,瓶Ⅱ中盛放的是_________________.
?___,瓶Ⅱ中盛放的是_________________.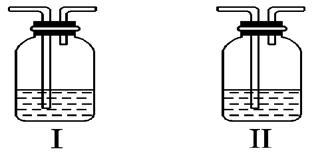
(5)实验中必须吸收多余的气体F,以免污染空气.下图是实验室用NaOH溶液吸收气体F的装置,为防止产生倒吸现象,合理的装置是________?____.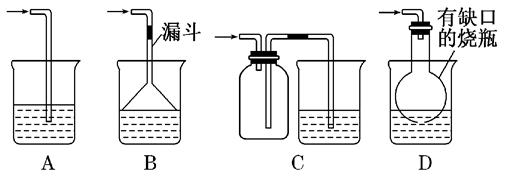
参考答案:
本题解析:略
本题难度:一般