时间:2025-06-25 22:58:33
1、选择题 下列过程需加入还原剂才能实现的是(?)
A.KMnO4→MnO2
B.HCO3-→CO2↑
C.HCl→Cl2
D.Cu2+→Cu
2、选择题 把一块镁铝合金投入到1 mol·L-1盐酸中,待合金完全溶解后,再往溶液里加入1 mol·L-1 NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示。下列说法中错误的是( )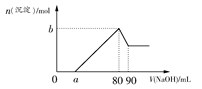
A.盐酸的体积为80 mL
B.a的取值范围为0<a<50
C.n(Mg2+)<0.025 mol
D.当a值为30时,b值为0.01
3、选择题 工业上可用硫酸铝与硫黄焙烧制备氧化铝:2Al2(SO4)3+3S  2Al2O3+9SO2↑,下列有关说法中正确的是
2Al2O3+9SO2↑,下列有关说法中正确的是
A.反应中Al2(SO4)3被氧化
B.Al2O3是氧化产物
C.该反应中,每转移0.3 mol电子生成5.04 L SO2
D.氧化产物与还原产物的质量之比为1
4、选择题 下列各项中表达正确的是(?)
A.N2的电子式:
B.二氧化碳分子的结构式为 O—C—O
C.CH4分子的比例模型:
D.F-的结构示意图
5、选择题 下列化学用语的书写正确的是
A.乙醇的结构简式C2H6O
B.一氯甲烷的分子式CH3Cl
C.硫原子的原子结构示意图
D.四氯化碳的电子式 