时间:2025-06-25 22:56:55
1、实验题 (12分)I.下图是某学生设计的制取和收集某些气体的实验装置(可加热)。
(1)该装置在加入反应物前,应首先进行的实验操作是?。
(2)下列气体的制取中,若用排空气法收集,可使用该装置制备和收集的是(选填编号,下同)__________若用排水法收集(集气瓶中充满水),可使用该装置制备和收集的是? ___________。
①用Zn与稀盐酸反应制H2?
②用CaCO3与稀盐酸反应制CO2?
③用固体NaOH和浓氨水制NH3?
④用Cu与稀HNO3反应制NO
⑤用MnO2与双氧水反应制O2
⑥浓硫酸与铜片反应制SO2
⑦用MnO2与浓盐酸反应制Cl2
II. 某校化学研究性学习小组对浓硫酸与金属锌的反应进行探究。首先按图组装好实验装置,然后取一定量的浓硫酸与足量Zn充分反应,微热试管A,实验过程中先观察到C、D中均有气泡产生,D中开始出现浑浊,后浑浊消失,随后气泡量逐渐减少,品红溶液褪色,反应较长时间后,C、D中的气泡量又 会明显增加。
会明显增加。
试回答:
(1)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接?、?接b,c接?、?接d;
(2)D、E试管中CCl4溶液的作用是防止溶液倒吸,该实验中起到同样作用的装置是____________;
(3)能证明浓硫酸具有强氧化性的实验现象为?;
(4)反应较长时间后气泡量又会明显增加的原因是?;
(5)D中浑浊消失的离子方程式为?。
参考答案:I、(1)检查装置气密性 (1分) (2)①③;①④⑤;(各2分)
II、(1)3或4? 4或3(1分)? 1? 2(1分)
(2)乙(填B也得分)(1分)
(3)C中品红溶液褪色(1分)?
(4)浓H2SO4变成 稀H2SO4,与Zn反应放出H2(1分)
稀H2SO4,与Zn反应放出H2(1分)
(5)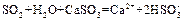 (2分)
(2分)
本题解析:略
本题难度:一般
2、选择题 工业上常用铁屑跟硫酸反应并经除杂、浓缩、结晶、干燥等过程,来制取绿矾晶体,为制得较纯净的绿矾晶体,合理的方法是?
A.使硫酸过量
B.使铁屑过量
C.使用稀H2SO4
D.使用浓H2SO4
参考答案:B、C
本题解析:要注意审题,制得较纯净的绿矾,则不应被O2氧化而变质,即铁要过量,合理方法应具备:不浪费原料,不引起污染。
本题难度:一般
3、实验题 草酸(H2C2O4)是一种重要的有机化工原料。为探究草酸的制取和草酸的性质,进行如下实验。
实验Ⅰ:实验室用硝酸氧化淀粉水解液法制备草酸,装置如下图所示
①一定量的淀粉水解液加入三颈烧瓶中
②控制反应温度55-60℃,边搅拌边缓慢滴加一定量的混合酸(65%的HNO3与98%的? H2SO4的质量比2︰1.25)
③反应3小时,冷却,抽滤后再重结晶得到草酸晶体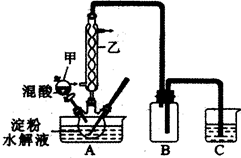
硝酸氧化淀粉水解液的反应为:C6H12O6+12HNO3 3H2C2O4+9NO2↑+3NO↑+9H2O
3H2C2O4+9NO2↑+3NO↑+9H2O
(1)上图实验装置中仪器甲的名称为:______________________________。
(2)检验淀粉是否水解完全所需要的试剂为:________________________。
实验Ⅱ:探究草酸的不稳定性
甲组同学查阅资料得知:草酸晶体(H2C2O4·2H2O)100℃开始失水,100.5℃左右分解产生H2O、CO和CO2。试用下图中提供的仪器和试剂,设计一个实验,证明草酸晶体分解得到的混合气体中含有H2O、CO和CO2(加热装置和导管等在图中略去,部分装置可以重复使用)。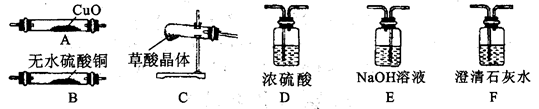
请回答下列问题:
(3)仪器装置连接顺序为:C→_______→F→_______→_______→D→A→F。?
(4)若实验结束后测得A管质量减轻4.8g,则需分解草酸晶体的质量为__________g。
(5)乙组同学查阅资料发现:草酸酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均是白色不溶物。通过进一步研究认为,草酸蒸汽与石灰水反应生成草酸钙白色沉淀,对实验有干扰,因此提出需要在检验CO2装置之前增加一个装有_________的洗气装置。(填写字母编号)。
A.水
B.氢氧化钠溶液
C.碳酸钠溶液
D.饱和碳酸氢钠溶液
实验Ⅲ:探究草酸与酸性高锰酸钾的反应
(6)向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,可推测草酸可能具有___________________性。
(7)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快。为探究其原因,同学们做了如下对比实验;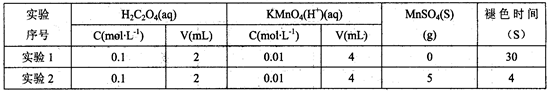
由此你认为溶液褪色总是先慢后快的原因是___________________________________。
(8)随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。钒元素广泛分散于各种矿物中,钾钒铀矿的主要成分可用化学式表示为? K2H6U2V2O15,测定其中钒元素含量的方法是:先把矿石中的钒元素转化为V2O5,V2O5在酸性溶液里转化为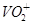 ,再用标准草酸溶液滴定。总反应可表示为:
,再用标准草酸溶液滴定。总反应可表示为:
□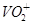 +□H2C2O4+□H+→□
+□H2C2O4+□H+→□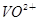 +□CO2+□H2O
+□CO2+□H2O
①请将上述反应配平(填写系数即可):_______________________________。
②现有钾钒铀矿样品10.2g,用上述方法来测定钒的含量,结果消耗0.9g草酸,那么此钾钒铀矿中钒元素的质量分数是_________________。
参考答案:(1)分液漏斗(1分)?(2)碘水或I2(1分)
(3)B E F (3分)?(4)37.8 (1分)
(5)A (1分)?(6)还原性(1分) ?
(7)反应生成的硫酸锰或锰离子对反应有催化作用,加快反应速率(1分)
(8)①2,1,2,2,2,2 (2分)?②10% (2分)
本题解析:(1)装置甲为分液漏斗(2)利用淀粉遇碘变蓝(3)应先检验水,连接装置B,检验CO2气体后应除去,连接装置E,最后证明CO,连接装置F。(4)A装置的质量减轻的质量就是O原子的质量可以求出CO的量,进而用方程式求出分解的草酸晶体的质量。(5)除去草酸蒸汽可以使用水进行除杂。(6)与酸性高锰酸钾发生氧化还原反应,说明它具有还原性。(7)反应中生成的Mn2+有催化作用,可以加快反应的速率。(8)①利用电子和原子守恒,可以配平反应方程式。②再利用配平的方程式带入计算可以求出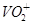 的量,进而求出钒元素的质量分数。
的量,进而求出钒元素的质量分数。
本题难度:困难
4、选择题 下列关于各实验装置的叙述正确的是( )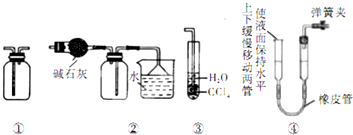
A.装置①可用于收集C2H4、HCl、SO2等气体
B.装置②可用于干燥、收集氯化氢,并吸收多余的氯化氢
C.装置③可用于吸收NH3、SO2、HCl等气体,并防止倒吸
D.装置④可用于检查该装置的气密性
参考答案:A、装置①收集气体时采用的是排空气法,要求所收集气体的密度要与空气的密度有一定的差距,乙烯的密度与空气接近,不能用该装置收集,故A错误;
B、碱石灰具有碱性,只能干燥碱性或中性气体,不能干燥酸性气体,氯化氢是酸性气体,所以不能用碱石灰干燥;收集HCl气体时,应该是长导管进气,短导管出气,故B错误;
C、装置③下层为CCl4,NH3或HCl、SO2易溶于水且不溶于CCl4的气体,可以用装置③并可防倒吸,故C正确;
D、装置④通过移动左管使两管液面相平,常用测量气体的体积,不能检查装置的气密性,故D错误;
故选C.
本题解析:
本题难度:简单
5、选择题 下列制备气体的实验设计中错误的是
参考答案:C
本题解析:在实验装置中要注意原理的分析,结合实验条件,同时要分析气体是否有毒、有污染等。A项制备氨气一般用固体氯化铵和氢氧化钙混合加热得到,正确;B项是制取氢气装置,正确;C项制取一氧化氮气体,因为一氧化氮气体易与空气中氧气反应结合生产二氧化氮,一般用排水法收集,错误;D项高锰酸钾与浓盐酸反应不需要加热,正确。
点评:Cl2、HCl、CO2、NO2、H2S、SO2等常见气体的制备原理要熟练掌握。本题难度一般。
本题难度:一般