时间:2025-06-25 22:56:55
1、实验题 (6分)实验室配制500ml 0.1mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取碳酸钠粉末??g。
(2)配制时应选用的仪器有500ml容量瓶,托盘天平、烧杯、药匙、?。
(3)若实验时遇到下列情况,所配溶液的浓度偏大的是?。
A.加水定容时超过刻度线,又吸出少量水至刻度线;
B.忘记将洗涤液转入容量瓶;
C.容量瓶洗涤后内壁有水珠而未作干燥处理;
D.称量碳酸钠粉末时左盘放砝码,右盘放药品;
E、定容时俯视刻度线。
参考答案:(1)5.3g;(2)玻璃棒、胶头滴管?(3)E
本题解析:略
本题难度:简单
2、填空题 实验室制取下列气体时,应选用下列哪种酸:(填入相应的字母。)
A.浓盐酸
B.稀盐酸
C.稀硫酸
D.浓硫酸
⑴用大理石和??制CO2 ;?⑵用MnO2和?制Cl2;
⑶用锌粒和??制H2 ;?⑷用食盐和??制HCl。
参考答案:(1) B? (2) A? (3) B或C? (4) D
本题解析:略
本题难度:简单
3、填空题 (12分)手持技术又称掌上技术,是由数据采集器、传感器和配套的软件成
的定量采集各种常见数据并能与计算机连接的实验技术系统。某研究小组利用手持技术,获得8.34gFeS04·7H20样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
请回答下列问题:
(1)试确定78℃时固体物质M的化学式:?。
(2)取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成且两种气体的组成元素相同,摩尔质量相差16,写出该反应的化学方程式?。
(3)某兴趣小组用如图所示装置设计实验,验证(2)中生成的气态物质,并测定已分解的P的质量(不考虑装置内空气的影响)。
①试剂X的名称是?。
②按气流方向连接各仪器,用字母表示接口的连接顺序:c?。
③充分反应后,利用装置Ⅲ中圆底烧瓶内混合物测定已分解的P的质量,其操作步骤为:第一步:向圆底烧瓶中逐滴加入氯化钡溶液,直至沉淀完全;第二步:过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重。第三步:继续烘干、冷却并称量直至连续两次 称量的质量差不超过0.1g为止。若最终得到沉淀的质量为Wg,则已分解的P的质量为??(填计算式)。
④上述测得P的质量比实际分解质量要小,原因是?。
参考答案:(1)FeS04·4H20?(2)2FeSO4 Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
(3)①品红溶液或溴水或酸性高锰酸钾溶液?
②a b
b f
f e
e d?③
d?③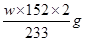
④由于生成的三氧化硫并没有完全被吸收,导致生成的硫酸钡质量减少
本题解析:(1)8.34gFeS04·7H20的物质的量是8.34g÷278g/mol=0.03mol,78℃是固体质量减少了8.34g-6.72g=1.62g,即相当于水的物质的量是1.62g÷18g/mol=0.09mol,所以固体中含有的结晶水是0.03mol×7-0.09mol=0.12mol,则化合物中含有的水分子个数是0.12mol÷0.03mol=4,则化学式是FeS04·4H20。
(2)固体加热到373℃时固体质量减少了8.34g-4.56g=3.78g,即相当于水的物质的量是3.78g÷18g/mol=0.21mol,这说明此时水已经完全失去。又因为两种气体的组成元素相同,摩尔质量相差16,所以该物质是二氧化硫和三氧化硫,因此反应的化学方程式是2FeSO4 Fe2O3+SO2↑+SO3↑。
Fe2O3+SO2↑+SO3↑。
(3)①二氧化硫具有漂白性和还原性,所以检验二氧化硫可以用品红溶液或溴水或酸性高锰酸钾溶液。
②三氧化硫溶于水生成硫酸,所以首先要通过冷却水得到三氧化硫,又因为二氧化硫是大气污染物,需要尾气处理,所以正确的顺序是c a
a b
b f
f e
e d。
d。
③根据题意最终得到的白色沉淀是硫酸钡,由于生成的硫酸来自于三氧化硫,所以根据S原子守恒可知,分解的硫酸亚铁的质量是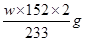 。
。
④由于生成的三氧化硫并没有完全被吸收,导致生成的硫酸钡质量减少,所以测得P的质量比实际分解质量要小。2的检验、三氧化硫的分离等
点评:固体是高考中的常见题型,属于较难的实验题。试题既有定性的分析,也有定量的计算,学生不易得分。本题用图表表述化学过程或呈现背景信息是化学常用的表达方式。图表往往拥有较大的信息存储量,能够很全面地考查学生分析、比较、概括、归纳问题的能力。
本题难度:一般
4、实验题 已知:CH3CH2OH+NaBr+H2SO4(浓) 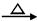 ?CH3CH2Br+NaHSO4 +H2O。
?CH3CH2Br+NaHSO4 +H2O。
实验室制备溴乙烷(沸点为38.4℃)的装置和步骤如下:
①按下图所示连接仪器,检查装置的气密性,然后向U形管和大烧杯里加入冰水;②在圆底烧瓶中加入10mL95%乙醇、28mL浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;③小火加热,使其充分反应。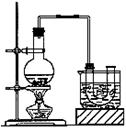
试回答下列问题:
(1)反应时若温度过高可看到有红棕色气体产生,该气体的化学式为
?。
(2)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是__________。
(3)反应结束后,U形管中粗制的溴乙烷呈棕黄色。将U形管中的混合物倒入分液漏斗中,静置,待液体分层后,分液,取?(填“上层”或“下层”)液体。为了除去其中的杂质,可选择下列试剂中的?(填序号)。
A.Na2SO3溶液
B.H2O
C.NaOH溶液
D.CCl4
(4)要进一步制得纯净的C2H5Br,可再用水洗,然后加入无水CaCl2干燥,再进行?(填操作名称)。
(5)下列几项实验步骤,可用于检验溴乙烷中的溴元素,其正确的操作顺序是:取少量溴乙烷,然后?(填序号)。
①加热?②加入AgNO3溶液?③加入稀HNO3酸化?④加入NaOH溶液?⑤冷却
参考答案:(1)Br2?(2)水浴加热?(3)下层,A?(4)蒸馏?(5)④①⑤③②
本题解析:(1)由于浓硫酸具有氧化性,能氧化溴化氢生成单质溴,溴蒸汽是红棕色的。
(2)水浴加热易于可知温度,所以应该用水浴加热。
(3)溴乙烷的密度大于水的,所以取下层液体。溴乙烷中含有单质溴,可以用亚硫酸钠还原单质溴来除去。由于氢氧化钠能和溴乙烷反应,所以正确的答案选A。
(4)溴乙烷属于有机物,不能溶于无机盐中,蒸馏即可。
(5)溴乙烷不能电离出溴离子,因此需要先通过水解产生溴离子,然后在加入硝酸银溶液。但由于溴乙烷水解在碱性条件下进行,而检验溴离子是在酸性条件下进行的,所以正确的顺序是④①⑤③②。
本题难度:一般
5、填空题 实验室制备溴代烃的反应如下:NaBr+H2SO4==HBr+NaHSO4?①
R-OH+HBr R-Br+H2O?②
R-Br+H2O?②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下;
| ? | 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 |
| 密度/g·cm-3 | ?0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
参考答案:(12分)(1)b?(2分)?
(2)小于(1分);醇可与水分子之间形成氢键,溴代烃不能与水分子之间形成氢键(2分)。
(3)下层(1分)?(4)a(2分)
(5)平衡向生成溴乙烷的方向移动(或反应②向右移动)(2分)
1-溴丁烷与正丁醇的沸点差较小,若边反应边蒸馏,会有较多的正丁醇被蒸出(2分)
本题解析:(1)容量瓶用于一定物质的量浓度溶液的配制,在该实验中最不可能用到,答案选b。
(2)醇可与水分子之间形成氢键,溴代烃不能与水分子之间形成氢键,所以溴代烃的水溶性小于相应醇的水溶性。
(3)根据表中数据可知,1-溴丁烷的密度大于水的密度,因此将1-溴丁烷的粗产品置于分液漏斗中加水,振荡后静止,产物即1-溴丁烷应在下层。
(4)由于加入的浓硫酸在稀释时放出大量的热且具有强氧化性,因此在准备操作过程中,加入的浓硫酸必须进行稀释,其目的就是防止放热导致副产物烯和醚的生成并减小HBr的挥发,同时也减少Br2的生成,即答案选a。
(5)根据平衡移动原理,蒸出产物平衡相有利于生成溴乙烷的方向移动;在准备1-溴丁烷时不能采取此方法,原因是1-溴丁烷与正丁醇的沸点相差较小,如果边反应边蒸,会有较多的正丁醇被蒸出。
点评:该题是高考中的常见题型,试题综合性强,难度较大。试题在注重对基础知识考查与训练的同时,侧重对学生实验探究能力的培养和训练。这些探究性和制备性实验的试题,综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般