时间:2025-06-25 22:56:04
1、填空题 缓冲溶液可以抵抗少量酸或碱对溶液PH的影响。人体血液里最主要的缓冲体系是碳酸氢盐缓冲体系(H2CO3/HCO3-),以维持血液PH的稳定。已知人体正常体温时,H2CO3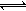 HCO3-+H+的Ka=10-6.1,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7则下列判断正确的是
HCO3-+H+的Ka=10-6.1,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7则下列判断正确的是
A.正常人血液内Kw=10-14
B.由题给数据可算得正常人血液的pH约为7.4
C.正常人血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3)
D.当过量的碱进入血液中时,只发生反应:HCO3-+OH—=CO32-+H2O
参考答案:B
本题解析:人体温度是37℃,所以正常人血液内水的离子积常数大于10-14,A不正确。根据Ka可知氢离子浓度为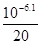 ,所以pH=7.4,B正确。根据电荷守恒可知,c(HCO3-)+c(OH-)+2c(CO32-)=c(H+),C不正确。D不正确,还发生碳酸和碱的反应,答案选B。【题型】选择题
,所以pH=7.4,B正确。根据电荷守恒可知,c(HCO3-)+c(OH-)+2c(CO32-)=c(H+),C不正确。D不正确,还发生碳酸和碱的反应,答案选B。【题型】选择题
本题难度:一般
2、选择题 下列叙述正确的是
A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液浓度大小关系为:c(NaOH)<c(CH3COONa)<c(Na2CO3)
B.0.1 mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
D.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
参考答案:D
本题解析:等浓度的CH3COONa溶液和Na2CO3溶液,由于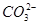 的水解程度大于CH3COO-的水解程度,Na2CO3溶液的碱性强于CH3COONa溶液的碱性,故等pH的两溶液,CH3COONa溶液的浓度大,A项错误;0.1 mol/L NaHA溶液的pH=4,说明溶液中存在HA-的电离和水解,且电离程度大于水解程度,电离产生H+和A2-,水解产生H2A和OH-,故c(A2-)>c(H2A),B项错误;使醋酸的pH增大1,需要将醋酸稀释的倍数要远大于10倍,C项错误;pH=11的NaOH溶液中c(OH-)=10-3 mol·L-1,pH=3的醋酸溶液中c(H+)=10-3 mol·L-1,但醋酸的浓度远大于NaOH溶液的浓度,二者等体积混合后醋酸过量,溶液呈酸性,滴入石蕊溶液呈红色。
的水解程度大于CH3COO-的水解程度,Na2CO3溶液的碱性强于CH3COONa溶液的碱性,故等pH的两溶液,CH3COONa溶液的浓度大,A项错误;0.1 mol/L NaHA溶液的pH=4,说明溶液中存在HA-的电离和水解,且电离程度大于水解程度,电离产生H+和A2-,水解产生H2A和OH-,故c(A2-)>c(H2A),B项错误;使醋酸的pH增大1,需要将醋酸稀释的倍数要远大于10倍,C项错误;pH=11的NaOH溶液中c(OH-)=10-3 mol·L-1,pH=3的醋酸溶液中c(H+)=10-3 mol·L-1,但醋酸的浓度远大于NaOH溶液的浓度,二者等体积混合后醋酸过量,溶液呈酸性,滴入石蕊溶液呈红色。
本题难度:一般
3、选择题 下列说法正确的是( )
A.NH3溶于水能导电所以NH3是电解质
B.硫化钠溶液必须用带橡胶塞的试剂瓶保存
C.常温下,7.1gCl2与足量NaOH溶液作用,转移电子的数目为0.2NA
D.下列离子在水溶液中能大量共存:Fe2+、NH4+、ClO-、Cl-
参考答案:A.氨气溶于水能导电,是由于氨气和水反应生成一水合氨,一水合氨电离出能自由移动的氨根离子和氢氧根离子,不是氨气自身电离,故A错误;
B.硫化钠在溶液中的水Na2S+H2O?NaHS+NaOH NaHS+H2O?H2S+NaOH,其溶液呈碱性,NaOH易和试剂瓶的成分玻璃瓶的磨口部分中的二氧化硅,发生反应,所以用橡皮塞来塞,故B正确; ?
C.7.1g氯气的物质的量为0.1mol,Cl2与足量NaOH溶液作用,Cl2+2NaOH=NaCl+NaClO+H2O,0.1mol的氯气中有0.2mol的氯原子,其中0.1mol的氯原子失去了0.1mol的电子成为了正一价的NaClO,另一0.1mol的氯原子得到0.1mol的电子,成了负一价的NaCl,转移电子的数目为0.1NA,故C错误;
D.ClO-具有氧化性,Fe2+具有还原性,它们间会发生:6Fe2﹢+3ClO-+3H2O═2Fe(OH)3+4Fe3+﹢3Cl-,不能共存,故D错误;
故选B.
本题解析:
本题难度:一般
4、填空题 某河道两旁有甲乙两厂.它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl--、OH-、NO3-?六种离子,已知甲厂的废水明显呈碱性.
(1)甲厂废水中所含的三种离子是______.
(2)如果加一定量______(选填:活性炭、铁粉),可以回收其中的金属______(填写金属元素符号).
(3)将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子转化为沉淀,转化为沉淀的离子分别为______(填写离子符号).经过滤后的废水主要含______(填化学式),可用来浇灌农田.
参考答案:(1)甲厂废水呈碱性,则溶液中含有大量的OH-,与OH-离子反应的Ag+、Fe3+不能大量共存,根据溶液电中性可知甲厂废水中应含有K+,乙厂中含有Ag+、Fe3+,则与Ag+、Fe3+反应的Cl--、OH-不能共存,,根据溶液电中性可知乙厂还有NO3-,
由此可知:甲厂含有K+、Cl--、OH-,乙厂含有Ag+、Fe3+、NO3-,故答案为:K+、Cl--、OH-;
(2)含有的金属离子有K+、Ag+、Fe3+,加入单质Fe,可置换出Ag,故答案为:铁粉;Ag;
(3)将甲厂和乙厂的废水按适当的比例混合,可生成AgCl、Fe(OH)3沉淀,生成沉淀的离子有Ag+、Fe3+、Cl--、OH-等,经过滤后的废水主要KNO3,故答案为:Ag+、Fe3+、Cl--、OH-;KNO3.
本题解析:
本题难度:一般
5、选择题 下列离子在溶液中能大量共存的是
?
A.NH4+、SO42-、NO3-、H+
B.I-、NO3-、H+、K+
C.NH4+、Cl-、OH-、NO3-
D.Na+、Ba2+、SO32-、SO42-
参考答案:A
本题解析:A 能大量共存。
B I-、NO3-、H+会发生氧化还原反应,不能大量共存
C NH4+、OH-不能大量共存
D Ba2+、SO32-、SO42-不能大量共存
本题难度:一般