时间:2025-06-25 22:56:04
1、选择题 某溶液只可能含有以下离子中的若干种:H+、NH4+ 、K+、Mg2+、NO2-、CO32-、NO3-?,现取两份200 mL溶液进行如下实验:(已知HNO2不稳定极易分解2HNO2===H2O+NO2↑+NO↑)①第一份加足量AgNO3溶液后,有11.68 g白色沉淀产生,沉淀中加入足量稀盐酸充分反应,有棕色气体产生,沉淀颜色不变,但是质量减少0.2 g;②将产生的气体全部通入过量的澄清石灰水,又得到白色沉淀2.0 g,该沉淀能溶于稀盐酸产生无色气体;③第二份加入过量浓NaOH溶液,加热使产生的气体全部放出,用100 mL 0.5 mol·L-1的稀硫酸恰好完全吸收,酸也不剩余。根据上述实验,以下推测不正确的是
A.原溶液一定不存在较大浓度的H+、Mg2+
B.原溶液确定含NH4+ 、NO2-、CO32-,且物质的量之比为5:2:1
C.不能确定原溶液是否含有K+、NO3-
D.实验中产生的棕色气体遇空气颜色会加深
参考答案:C
本题解析:本题考查了离子检验,意在考查考生的计算能力和判断能力。根据实验①②可推知,溶液中含有CO32-、NO2-,则一定不存在较大浓度的H+、Mg2+,A选项正确;根据实验③可知含有NH4+ ,由H2SO4+2NH3===(NH4)2SO4得,n(NH4+ )=2n(SO42-)=2×0.1 L×0.5 mol·L-1=0.1 mol;11.68 g沉淀为Ag2CO3和AgNO2的混合物,n(CO32-)=n(CaCO3)=2.0 g÷100 g·mol-1=0.02 mol,则m(Ag2CO3)=0.02 mol×276 g·mol-1=5.52 g,m(AgNO2)=11.68 g-5.52 g=6.16 g,n(NO2-)=n(AgNO2)=6.16 g÷154 g·mol-1=0.04 mol,所以原溶液确定含NH、NO、CO,且物质的量之比为5:2:1,B选项正确;根据电荷守恒可知,溶液中一定有NO3-,不能确定是否含有K+,C选项错误;产生的棕色气体为NO、NO2和CO2的混合物,NO遇空气会生成NO2,颜色会加深,D选项正确。
本题难度:一般
2、选择题 下列各组中的离子,能在溶液中大量共存的是( )
A.Cu2+、H+、Cl-、SO42-
B.Na+、Fe3+、SO42-、OH-
C.H+、Na+、CO32-、NO32-
D.K+、Na+、Cl-、OH-
参考答案:A.因该组离子之间不反应,则能够大量共存,故A正确;
B.因Fe3+、OH-能结合生成氢氧化铁沉淀,则不能共存,故B错误;
C.因H+、CO32-能结合生成水和二氧化碳,则不能共存,故C错误;
D.因该组离子之间不反应,则能够大量共存,故D正确;
故选AD.
本题解析:
本题难度:一般
3、填空题 (6分)某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42- 等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是___________________,且各离子的物质的量之比为___________________;肯定不含的阳离子是____________________。写出平行线段线所发生反应的离子方程式: 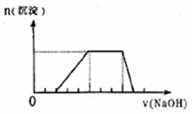
参考答案: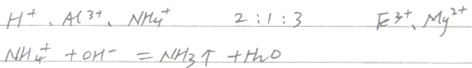
本题解析:由图,开始加入NaOH溶液,无沉淀生成则溶液中含有H+,再加入NaOH溶液有沉淀生成则溶液中可能有Mg2+、Fe3+、Al3+、,再加入NaOH溶液,沉淀不变化则溶液中有NH4+,再加入NaOH溶液,沉淀溶解最后消失则溶液中有Al3+无Mg2+、Fe3+;根溶液呈电中性的原则,可得H+,Al3+,NH4+,的物质的量之比为2:1:3;
本题难度:一般
4、选择题 下列各组离子,在溶液中可以大量共存的是
A.Ag+、Ca2+、Cl-、NO3-
B.K+、NH4+、CO32-、OH-
C.Na+、Cl-、CO32-、OH-
D.H+、K+、CO32-、NO3-
参考答案:C
本题解析:A.Ag+、Cl-、生成AgCl沉淀;B. NH4+、OH-生成NH3; C.可以共存 D.H+、CO32-、生成CO2;选C。
本题难度:一般
5、选择题 下列各组离子在指定溶液中可能大量共存的是
[? ]
A.无色溶液中:Na+、K+、MnO4-、SO42-
B.在能使酚酞试液显红色的溶液中:K+、Na+、S2-、SO32-
C.使甲基橙变红的溶液中:Al3+、NO3-、I-、Cl-
D.加入铝能放出氢气的溶液中:?Na+、K+、Cl-、CO32-
参考答案:BD
本题解析:
本题难度:一般