时间:2025-06-25 22:53:39
1、选择题 据报道,美国正在研究的锌电池可能取代目前广泛使用的铅蓄电池,它具有容量大等优点,其电池反应为2Zn+O2=2ZnO,其原料为锌、电解液和空气,则下列叙述正确的是
[? ]
A.锌为正极,空气进入负极反应
B.负极反应为Zn-2e-=Zn2+
C.正极发生氧化反应
D.电解液肯定不是强酸
参考答案:BD
本题解析:
本题难度:一般
2、选择题 据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,其电池反应为:
2CH3OH+3O2+4OH-?
?2CO32-+6H2O,下列说法错误的是( )
A.放电时CH3OH参与反应的电极为负极
B.充电时每生成1molCH3OH转移12mol电子
C.放电时负极的电极反应为:CH3OH+8OH--CO32-+6H2O+6e--
D.充电时电解质溶液的pH逐渐增大
参考答案:A、放电时,负极是甲醇发生失电子的氧化反应,故A正确;
B、充电时,根据电池反应可知每生成2molCH3OH转移电子12mol,所以充电时每生成1molCH3OH转移6mol电子,故B错误;
C、放电时,负极是甲醇发生失电子的氧化反应,即CH3OH+8OH-=6H2O+CO32-+6e-,故C正确;
D、充电时,相当于电解池的工作原理,根据反应方程式发现此时生成了氢氧根离子,所以电解质溶液的pH逐渐增大,故D正确.
故选B.
本题解析:
本题难度:一般
3、填空题 )电子表和电子计算器的电池常用微型银—锌原电池,其电极分别为Zn和Ag2O,电解质溶液为KOH溶液,负极反应 和总反应分别为:Zn+2OH - -2e==ZnO+H2O和Ag2O+Zn==ZnO+2Ag
(1)该原电池工作时负极区溶液的PH值 ?(上升、下降或不变)
(2)该原电池工作时电子由?(Zn或Ag2O)极经外电路流向 ?(正或负)极。正极上发生的电极反应为?
参考答案: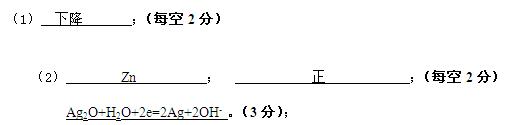
本题解析:略
本题难度:简单
4、简答题 氢氧燃料电池是符合绿色化学理念的新型发电装置,右图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
(1)氢氧燃料电池的能量转化主要形式是______,在导线中电子流动方向为(用a、b表示)______.
(2)负极的电极反应式为______.
(3)电极表面镀铂粉的原因为______.
(4)关于该电池的说法错误的是______
A.氢气在负极发生氧化反应?B.供电时的总反应为:2H2+O2=2H2O
C.产物为无污染的水,属于环境友好电池?D.燃料电池的能量转化率可达100%
(5)在下图所示的装置中,能够发生原电池反应的是______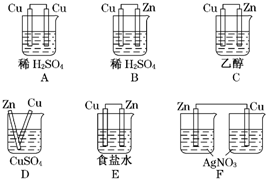
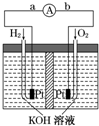
参考答案:(1)该装置是把化学物质中的能力转化为电能,所以是化学能转变为电能;在原电池中,负极上失电子,正极上得电子,电子的流向是从负极流向正极,所以是?由a到b.
故答案为:化学能转变为电能;?由a到b.
(2)该反应中氢气失电子被氧化,氢气失电子生成氢离子,氢离子和溶液中的氢氧根离子生成水,所以电极反应式为2H2+4OH--4e-=4H2O或H2+2OH--2e-═2H2O.
故答案为:2H2+4OH--4e-═4H2O或 H2+2OH--2e-═2H2O.
(3)电极表面镀铂粉,增大了电极单位面积吸附H2、O2的分子数,使反应物的浓度增大,反应物浓度增大,反应速率加快.
故答案为:增大电极单位面积吸附H2、O2的分子数,加快电极反应速率.
(4)A氢气在负极上失电子发生氧化反应,故A正确.
B、该装置的电池反应式为2H2+O2=2H2O,所以供电时的总反应为:2H2+O2=2H2O,故B正确.
C、产物为无污染的水,属于环境友好电池,故C正确.
D、燃料不可能完全燃烧,所以转化率不可能为100%,故D错误.
故选D.
(5)原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.
A、电极材料相同,故A错误.
B、符合原电池的构成条件,故B正确.
C、乙醇为非电解质,不能进行氧化还原反应,故C错误.
D、符合原电池的构成条件,故D正确.
E、符合原电池的构成条件,故E正确.
F、不能形成闭合回路,故F错误.
故选BDE.
本题解析:
本题难度:一般
5、选择题 我国镍氢电池居世界先进水平,国产大功辜镍氢动力电池已广范用于我海军舰艇。常见镍氢电池的某极是储氢合金,电池的总反应为下式,则下列说法正确的是
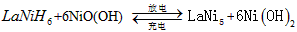 (
(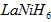 中各元素化合价均为零)
中各元素化合价均为零) 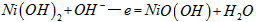
参考答案:B
本题解析:
本题难度:一般