时间:2025-06-25 22:42:20
1、填空题 某澄清溶液中,可能存在Na+、Fe2+、I-、Br-、CO2-3、SO2-3六种离子中的几种.?将该溶液进行如下实验(已知氧化性Cl2>IO-3):
(1)滴加过量的新制氧水,溶液变黄色,并有气泡生成;
(2)向(l)中的所得溶液中加入BaCl2溶液,无沉淀生成;结论是______.
(3)向(1)中所得溶液中加入淀粉溶液溶液,不显蓝色;
根据上述实验推断溶液中一定存在的离子是______.溶液中一定不存在的离子是______.
2、选择题 在无色透明的强碱性溶液中,下列各组离子能大量共存的是(?)
A.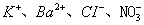
B.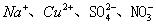
C.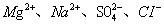
D.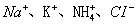
3、填空题 某溶液中含有SO42-、CO32-、Cl-三种阴离子。如果每次只检验一种离子,要↑
(1)先检验?,加入?试剂(或溶液),反应的离子方程式为?;
(2)然后检验?,加入?试剂(或溶液),反应的离子方程式为?;
(3)最后检验?,加入?试剂(或溶液),反应的离子方程式为?。
4、选择题 在水溶液中能大量共存的一组离子是
A.Fe3+ 、I-、ClO-、H+
B.K+、Cu2+、OH-、NO3-
C.NH4+、Na+、Br-、SO42-
D.Al3+、Cl-、OH-、HCO3-
5、选择题 常温下,下列各组溶液中的离子一定能大量共存的是( )
A.c(H+)=
| Kw |