时间:2025-06-25 22:35:39
1、选择题 下列四种溶液中,加入少量括号内试剂,在温度不变时,溶液pH值下降的是( )
A.0.1mol/L氨水(AgOH固体)
B.饱和石灰水(CaO)
C.0.1mol/LNaHS溶液(CuCl2固体)
D.饱和氯水(Na2SO3固体)
参考答案:CD
本题解析:
本题难度:简单
2、选择题 下列事实不能证明HNO2是弱酸的是( )
A.常温下NaNO2溶液的pH>7
B.用HNO2溶液做导电实验,灯泡很暗
C.0.1mol?L-1的HNO2溶液的pH=2
D.pH=3的HNO2溶液稀释至100倍后,3<pH<5
参考答案:A.常温下,NaNO2溶液的pH>7,说明亚硝酸钠是强碱弱酸盐,亚硝酸为弱酸,故A不选;
B.溶液的导电能力与离子浓度成正比,与电解质强弱无关,故B选;
C.0.1mol?L-1的HNO2溶液的pH=2>1,说明亚硝酸不完全电离,为弱酸,故C不选;
D.pH=3的HNO2溶液稀释至100倍后,3<pH<5,说明亚硝酸溶液中存在亚硝酸电离平衡,为弱酸,故D不选;
故选B.
本题解析:
本题难度:简单
3、填空题 合成氨反应N2(g)+3H2(g)? 2NH3(g)?ΔH=-94.2kJ·mol-1,分别在反应条件不同,但体积均为2L的三个固定体积的容器中反应,起始时N2、H2和NH3的物质的量分别为2mol、6mol、0mol,N2的物质的量随时间的变化如图所示。请回答下列问题:
2NH3(g)?ΔH=-94.2kJ·mol-1,分别在反应条件不同,但体积均为2L的三个固定体积的容器中反应,起始时N2、H2和NH3的物质的量分别为2mol、6mol、0mol,N2的物质的量随时间的变化如图所示。请回答下列问题: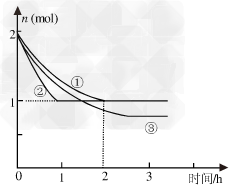
(1)与①比较,②和③分别仅改变一种? 反应条件。所改变的条件是: ②___________________;③__________________;
(2)实验①的平衡常数K=____________(用最简分数表示),该反应进行到2h时的平均反应速率vH2=______________;
(3)氨是工业合成尿素(H2NCONH2)的重要原料,工业上合成尿素的反应分为如下两步:
第1步:2NH3(l)+CO2(g)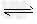 H2NCOONH4(氨基甲酸铵)?(l)? △H1=?-330.0?kJ·mol-1
H2NCOONH4(氨基甲酸铵)?(l)? △H1=?-330.0?kJ·mol-1
第2步:H2NCOONH4(l)? H2O(l)+H2NCONH2(l)?△H2=+226.0?kJ·mol-1
H2O(l)+H2NCONH2(l)?△H2=+226.0?kJ·mol-1
则2NH3(l)+CO2(g)? H2O(l)+H2NCONH2?(l)? △H=______________。
H2O(l)+H2NCONH2?(l)? △H=______________。
(4)工业上利用反应?3Cl2?+?2NH3?=N2?+?6HCl?检查氯气管道是否漏气。当转移6?mol?电子时,生成氮气在标准状况下的体积是_________L。
(5)相同pH的氨水和NaOH溶液加水稀释相同的倍数,pH变化曲线如图所示,则x曲线代表的物质是______,当a=9时,稀释后溶液的体积是稀释前溶液体积的_______倍。 
参考答案:(1)加入催化剂 ;降低温度。
(2)16/27?L2·mol-2?;0.75?mol·L-1·h-1
(3)-104?kJ·mol-1?
(4)22.4
(5)氨水 ;100
本题解析:
本题难度:一般
4、选择题
| 化学式 | 电离常数 (25℃) HCN 4.9×l0-10 H2CO3 K1=4.3×l0-7 K2=5.6×l0-11 |
参考答案:AB
本题解析:
本题难度:一般
5、填空题 (8分)一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,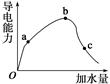
请回答:
(1)O点为什么不导电:_______________________________。
(2)a、b、c三点溶液的pH由小到大的顺序是______________。
(3)H+的物质的量最大的是________(填“a”、“b”或“c”)。
(4)若使c点溶液中的c(CH3COO-)增大,可以采取下列措施中的________(填序号)。
A.加热
B.加很稀的NaOH溶液
C.加NaOH固体
D.加水
E.加入锌粒
参考答案:18.(8分)(1)无自由移动的离子 (2)b<a<c (3)c (4)ACE
本题解析:(1)冰醋酸是纯净的醋酸,只有电解质分子,没有发生电离。没有自由移动的离子所以不能导电。(2)自由移动的离子浓度越大,溶液的导电性就越强,由于导电性b>a>c,所以氢离子的浓度大小顺序是:b>a>c。氢离子的浓度越大,溶液的PH就越小,a,b,c三点的pH由小到大的顺序是b<a<c.(3)加入的水越多,电离的电解质就越多,电离程度就越大。所以 a、b、c三点中电离程度最大的是c,次点H+的物质的量最大;(4)A电解质电离过程是个吸热过程,加热,是温度升高,可以使平衡向电离的方向移动,导致c(CH3COO-)增大,A正确。B.加很稀的NaOH溶液,消耗了氢离子,减小了氢离子的浓度,是电离平衡向电离的方向移动,但由于是稀溶液,最终氢离子的浓度及c(CH3COO-)反而减小,B错误。C.加NaOH固体消耗氢离子,破坏了电离平衡,使电离平衡向电离的方向移动。由于醋酸跟离子没有消耗所以最后c(CH3COO-)增大,C正确。D.加水,平衡正向移动,电解质分子的浓度减小。由于电离平衡移动使c(CH3COO-)增大的趋势小于水对它的稀释作用,最后c(CH3COO-反而减小,D错误。E.加入锌粒消耗氢离子,破坏了电离平衡,促使它向电离的方向移动,最终 c(CH3COO-)增大,E正确。选A C E 。
考点:考查溶液的导电性与溶液稀释的关系及外界条件对电离平衡的影响的知识。
本题难度:一般