时间:2025-06-25 22:31:31
1、实验题 常温下,将HCl溶液和一元碱AOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 | HCl物质的量浓度(mol·L-1) | AOH物质的量浓度(mol·L-1) | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.1 | c | pH=7 |
| 丙 | 0.1 | 0.1 | pH=5 |
参考答案:(1)a=7,AOH为强碱;a<7,AOH为弱碱。
(2)否;(3)10-5;
本题解析:略
本题难度:一般
2、选择题 25℃时,0.1mol/L稀醋酸加水稀释,右图坐标中的纵坐标y可以是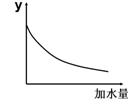
A.溶液的pH
B.醋酸的电离平衡常数
C.溶液的导电能力
D.醋酸的电离程度
参考答案:C
本题解析:略
本题难度:简单
3、选择题 部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K=1.77×10-4 | K=4.9×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
参考答案:A
本题解析:根据表中数据判断酸性强弱顺序为:HCOOH >H2CO3>HCN >HCO3-,结合强酸制弱酸的原理分析,A正确;B、酸性:HCOOH >HCN,根据水解理论,碱性:HCOONa<NaCN;C、酸的物质的量相同,消耗氢氧化钠一样多;D、NaHCO3溶液呈碱性,水解程度大于电离程度。
本题难度:一般
4、选择题 pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH与溶液体积(V)的关系如图所示。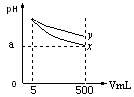
下列说法正确的是( )。
A.稀释后x溶液中水的电离程度比y溶液中水电离程度小
B.若x、y是一元碱,等物质的量浓度的盐酸盐溶液y的pH大
C.若x、y都是弱碱,则a的值一定大于9
D.完全中和x、y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y)
参考答案:C
本题解析:由图可知pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH的变化x更大,所以可知碱性强弱关系为: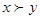 ;y一定是弱碱;所以
;y一定是弱碱;所以
A错,由于稀释后x溶液的PH更小,所以稀释后x溶液中水的电离程度比y溶液中水电离程度大;B错,若x、y是一元碱,等物质的量浓度的盐酸盐溶液y的pH小,C正确;D错,完全中和x、y两溶液时,消耗同浓度稀硫酸的体积V(x)<V(y);
本题难度:一般
5、选择题 已知某弱酸的酸式盐有NaH2XO4和Na2HXO4,其中NaH2XO4的溶液呈酸性,Na2HXO4溶液呈碱性。30℃时,浓度均为0.1mol?L-1NaH2XO4溶液和Na2HXO4溶液中均存在的关系是
A.c(H+)?c(OH-) >1×10-14
B.c(H+) + 2c(H3XO4)+ c(H2XO4-)=c(XO43-)+ c(OH-)
C.c(H+) + c(H3XO4)= c(HXO42-)+ 2c(XO43-)+ c(OH-)
D.c(Na+)+ c(H+)= c(H2XO4-)+ c(OH-)+ 2c(HXO42-)+ 3c(XO43-)
参考答案:AD
本题解析:NaH2XO4和Na2HXO4虽然溶液酸碱性不同,但溶液中离子种类是完全相同的,差别只是各种离子多少的不同。所以两种溶液中都存在相同的电荷守恒。因为温度高于25℃,此时水的离子积常数随温度升高而增大,所以A正确。
本题难度:简单