时间:2025-06-25 22:31:31
1、选择题 下列关于弱电解质的说法正确的是:?(?)
A.电解质越弱,则其溶液的导电能力就越差
B.同一弱电解质,浓度越大,电离程度越大
C.升高温度,弱电解质的电离程度减小
D.弱电解质的相对强弱可由相同温度下的电离常数值的大小来判断
参考答案:D
本题解析:A错误,电解质的强弱与其在溶液中导电能力的大小没有直接关系,溶液中导电能力大小只与溶液中的离子浓度和离子所带电荷数目有关。
B错误,对于弱电解质,浓度越大,电离程度越小。
C错误,电离过程是吸热,升高温度,弱电解质的电离平衡正向移动,电离程度增大。
D正确。
本题难度:简单
2、填空题 (18分)
Ⅰ.(7分)次磷酸(H3PO2)是一种一元中强酸,具有较强的还原性。试回答下列问题:
(1)P的原子结构示意图为 ;
(2)NaH2PO2为 (填“正盐”或“酸式盐”),溶液中有关离子浓度从大到小的顺序为 。
(3)H3PO2可将溶液中的银离子还原为银单质,若氧化剂与还原剂的物质的量之比为4
参考答案:
本题解析:
本题难度:困难
3、填空题 pH=12的氢氧化钠溶液稀释100倍后,pH=
参考答案:10
本题解析:略
本题难度:一般
4、选择题
A.醋酸与锌反应放出氢气多
B.盐酸和醋酸分别与锌反应放出的氢气一样多
C.醋酸与锌反应速率大
D.盐酸和醋酸分别与锌反应的速率一样大
参考答案:BC
本题解析:pH相同的盐酸和醋酸都稀释2倍,盐酸中c(H+)变为原来的一半,而醋酸是弱酸,稀释后,电离程度增大,c(H+)比稀释前小,但大于原来浓度的一半,即比盐酸溶液中H+的浓度大,锌与醋酸的反应速率快;酸和锌的量都是已知的,首先进行过量判断,经计算锌的量不足,所以两种溶液放出H2的量是相等的。
本题难度:简单
5、填空题 已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH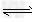 CH3COO-+H+?ΔH>0。
CH3COO-+H+?ΔH>0。
(1)常温常压下,在?pH?=5的稀醋酸溶液中,c(CH3COO-)=____________;下列方法中,可以使0.10?·L-1?CH3COOH的电离程度增大的是______________?
a.加入少量0.10?mol·L-1的稀盐酸?
b.加热CH3COOH溶液
c.加水稀释至0.010?mol·L-1?
d.加入少量冰醋酸
e.加入少量氯化钠固体?
f.加入少量0.10?mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V盐酸_________V醋酸?,反应的最初速率为:υ盐酸_________υ醋酸。
(3)常温下,向体积为Va?mL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液Vb?mL至溶液恰好呈中性,则Va与Vb的关系是:__________________;溶液中各离子的浓度按照由大到小排序为___________________________________.已知:90℃时,水的离子积常数为Kw?=?38×10-14,在此温度下,将pH=3的盐酸和pH?=?11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=______________(保留三位有效数字)。
参考答案:(1)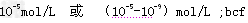
(2)< ;=
(3)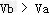 ;
;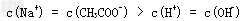 ?;
?;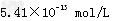
本题解析:
本题难度:一般