时间:2025-06-25 22:27:36
1、填空题 用霞石岩(化学式为?KNa3[AlSiO4]4,主要成份Na2O、K2O、Al2O3、SiO2)制碳酸钠、碳酸钾和氧化铝的工艺流程如下: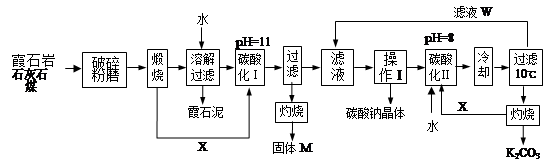
已知:NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12。溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中。部分物质的溶解度见右图。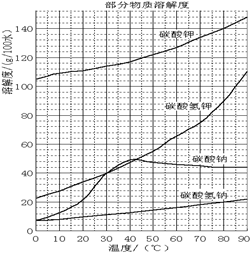
试回答下列问题:
(1)灼烧得到固体M的化学方程式是________________________________。
(2)X物质是___________,滤液W中主要含有的离子有____________。(写三种)
(3)操作Ⅰ得到碳酸钠晶体的操作为 ?、?、?、洗涤、干燥。
(4)碳酸化Ⅰ中发生主要反应的离子方程式是__________________________。
(5)碳酸化Ⅱ调整pH=8的目的是_______________________________。
参考答案:(1)2Al(OH)3 Al2O3+ 3H2O (3分)
Al2O3+ 3H2O (3分)
(2)CO2或二氧化碳(2分)? Na+、K+、HCO3?(3分,各1分,错写、多写每个倒扣1分至0分)
(3)蒸发浓缩、冷却结晶、过滤(3分,各1分)
(4)2AlO2? + CO2 + 3H2O =2Al(OH)3↓+ CO32?(3分,产物写成HCO3—给0分)
(5)碳酸根转化为碳酸氢根离子(1分),利于KHCO3结晶析出(1分)
本题解析:(1)在高温下矿石、石灰石、煤混合反应生成的X可以进行碳酸的酸化,实验中X一定是CO2气体。溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中,所以通入CO2后一定生成氢氧化铝沉淀,灼烧则得到氧化铝,即M是氧化铝,所以灼烧得到固体M的化学方程式是2Al(OH)3 Al2O3+ 3H2O。
Al2O3+ 3H2O。
(2)物质X是二氧化碳,滤液W可以循环使用,用来制备碳酸钠和碳酸钾,所以其中主要含有的离子有Na+、K+、HCO3-。
(3)碳酸化Ⅰ的目的是制备氢氧化铝,又因为溶液的pH=11,所以生成的是碳酸盐,而不是碳酸氢盐,即该反应的离子方程式应该是2AlO2-+CO2+3H2O→2Al(OH)3↓+CO32-,故答案为:2AlO2-+CO2+3H2O→2Al(OH)3↓+CO32-;
(4)操作Ⅰ的目的是制备碳酸钠,根据物质的溶解度表可知,碳酸钠的溶解度随温度的升高而增大,所以操作应该是蒸发浓缩,冷却结晶,然后过滤、洗涤、干燥即可。
(5)已知NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12,所以碳酸化Ⅰ中的生成物是碳酸盐,而不是碳酸氢盐,因此反应的离子方程式为2AlO2? + CO2 + 3H2O =2Al(OH)3↓+ CO32?。
(6)由于NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12,而碳酸氢钾灼烧生成碳酸钾,所以碳酸化Ⅱ调整pH=8的目的是使碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出。
本题难度:困难
2、选择题 下图实验装置一般不用于分离物质的是
[? ]
A.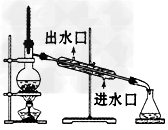
B.
C.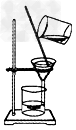
D.
参考答案:D
本题解析:
本题难度:简单
3、选择题 1gCO2含有CO2分子a个,则阿伏加德罗常数的数值可表示为
A.22a
B.28a
C.44a
D.88a
参考答案:C
本题解析:分析:根据n= 计算1gCO2的物质的量,再根据N=nNA计算阿伏加德罗常数,据此计算判断.
计算1gCO2的物质的量,再根据N=nNA计算阿伏加德罗常数,据此计算判断.
解答:1gCO2的物质的量为 =
= mol,
mol,
所以 mol×NA=a
mol×NA=a
解得NA=44amol-1.
所以阿伏伽德罗常数的数值为44a.
故选:C
点评:考查阿伏伽德罗常数的计算,难度不大,注意公式运用及阿伏伽德罗常数的单位.
本题难度:简单
4、选择题 从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是( )
A.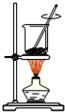
海带灼烧成灰
B.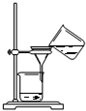
过滤得含I-的溶液
C.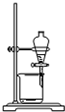
放出碘的苯溶液
D.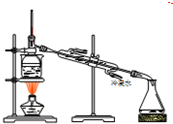
分离碘并回收苯
参考答案:A.不能在烧杯中高温灼烧固体,烧杯易炸裂,固体的灼烧应在坩埚中,故A错误;
B.过滤应用玻璃棒引流,防止浊液外漏,故B错误;
C.苯的密度比水小,应从上口倒出,防止污染,故C错误;
D.碘易升华,蒸馏时,冷凝管应从下端进水,上端出水,故D正确.
故选D.
本题解析:
本题难度:一般
5、填空题 辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下: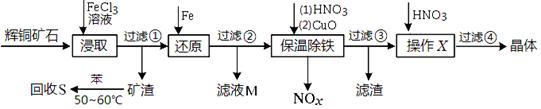
(1)写出步骤“还原”中可能发生反应的离子方程式?、?。
(2)回收S过程中温度控制50℃~60℃之间,不宜过高或过低的原因是?、?。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该物质的化学式为?;向滤液M中加入(或通入)下列?(填字母)物质,得到另一种可循环利用的物质。
a.铁? b.氯气? c.高锰酸钾? d.盐酸
(4)保温除铁过程中加入CuO的目的是?、?;
(5)过滤③所得到的滤液,加入硝酸后,经操作X、过滤④得到硝酸铜晶体。
硝酸的作用是?;
操作X是?、?(填操作名称) 。
参考答案:(1)Fe +2Fe3+→3Fe2+?Fe +Cu2+→Cu+Fe2+
(2)温度高苯容易挥发,温度低溶解速率小
(3)HNO3 (1分) ?b (2分)
(4)调节溶液的pH,使Fe3+完全转化为Fe(OH)3沉淀
(5)抑制Cu2+的水解(1分)?蒸发浓缩、冷却结晶(2分)
本题解析:(1)辉铜矿与氯化铁溶液反应生成氯化铜、氯化亚铁和单质硫,二氧化硅不反应与单质硫一起形成矿渣,滤液中含有铁离子、铜离子,所以加入铁粉反应的反应有Fe +2Fe3+→3Fe2+ 、Fe +Cu2+→Cu+Fe2+。
(2)苯是有机溶剂,易挥发,所以温度高苯容易挥发,而温度低溶解速率小,因此回收S过程中温度控制50℃~60℃之间,不宜过高或过低。
(3)气体NOx与氧气混合后通入水中能生成硝酸,所以可循环利用的物质化学式为HNO3。滤液M是氯化亚铁,可以再转化为氯化铁而循环利用,所以该试剂应该是氯气,答案选b。
(4)氧化铜是碱性氧化物,能与酸反应调节溶液的pH值,所以氧化铜的作用是调节溶液的pH,使Fe3+完全转化为Fe(OH)3沉淀而析出。
(5)硝酸铜溶液中的铜离子易水解,所以加入硝酸的作用是抑制Cu2+的水解;从溶液中得到硝酸铜晶体的实验操作应该是蒸发浓缩、冷却结晶。
本题难度:一般