时间:2025-06-25 22:24:21
1、选择题 下列物质溶于水时会破坏水的电离平衡,且属于电解质的是(?)
A.氯气
B.二氧化碳
C.碘化钾
D.醋酸钠
2、选择题 某温度下,X(g)+Y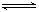 2Z反应达到平衡,在升高温度或减小压强的情况下,平衡均向右移动,则下列有关反应的各种叙述中正确的是
2Z反应达到平衡,在升高温度或减小压强的情况下,平衡均向右移动,则下列有关反应的各种叙述中正确的是
A.正反应是吸热反应,Z是固体
B.逆反应是放热反应,Y是固体,Z为气体
C.正反应是吸热反应,只有Z不是气体
D.正反应是放热反应,Y和Z均为气体
3、选择题 在一个固定体积的密闭容器中加入2mol A,发生可逆反应2A(g)  2B(g)+C(g)。该反应达到平衡的标志是
2B(g)+C(g)。该反应达到平衡的标志是
A.容器内压强是开始时的1.5?
B.容器内A、B、C物质的量浓度之比为2∶2∶1
C.单位时间消耗0.2molA,同时生成0.1molC?
D.容器内各物质的浓度不随时间变化
4、选择题 下列图示与对应的叙述相符的是(? ) 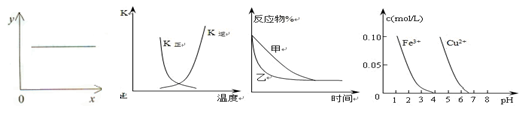
图1?图2?图3?图4
A.图1表示反应2NO(g)+2CO(g)  N2(g)+2CO2(g)平衡常数K 随NO物质的量的变化
N2(g)+2CO2(g)平衡常数K 随NO物质的量的变化
B.图2中表示反应2A(g) + B(g) 2C(g) ΔH > 0的平衡常数K随温度的变化
2C(g) ΔH > 0的平衡常数K随温度的变化
C.图3表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的大
3C(g)+D(s)的影响,乙的压强比甲的大
D.据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在5左右
5、选择题 将1 molCO和1 molH2O混合在一定条件下反应: CO+H2O(气) CO2+H2,达到平衡时剩余了75%的CO, 此平衡混合气的密度是相同条件下氢气的
CO2+H2,达到平衡时剩余了75%的CO, 此平衡混合气的密度是相同条件下氢气的
A.11.5倍
B.5.75倍
C.23倍
D.30.67倍