时间:2025-06-25 22:19:26
1、选择题 下列说法正确的是
①NaHCO3溶液加水稀释,c(Na+)/ c(HCO3-)的比值保持增大
②浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO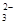 )+c(HCO
)+c(HCO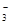 )]
)]
③在0.1 mol·L-1氨水中滴加0.lmol·L-1盐酸,恰好完全中和时pH=a,则由水电离产生的
c(OH-)=l0-amol·L-1
④已知:Ksp(AgCl)=1.8xl0-10,? Ksp(A92Cr2O4)=2.0×l0-12,则Ag2CrO4的溶解度小于AgCl
A.①④
B.②③
C.①③
D.②④
参考答案:C
本题解析:①两者的浓度之比等于物质的量之比,稀释时,促进碳酸氢根离子的电离和水解,碳酸氢根离子的物质的量减小,钠离子的物质的量不变,故两者的比值增大,①正确;②溶液中含碳的微粒还有碳酸分子,故②错误;③恰好完全中和时生成氯化铵溶液,溶液中的氢离子是水电离出的,由水电离出的氢离子等于由水电离生成的氢氧根离子,故③正确;④有Ksp的表达式可以求出溶液中离子的浓度,根据离子浓度比较,重铬酸钾溶液中离子浓度大,故溶解度大,④错误;故选C。
本题难度:一般
2、填空题 (6分)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。请填写下列空白:
(1)终点的判断:溶液由_____________________________________________________。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是(? )
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用
盐酸溶液的体积为_________ml。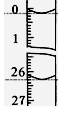
(4)某学生根据3次实验分别记录有关数据如表:
| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000 mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 平均耗用盐酸 体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.15 | ①V=__________ |
| 第二次 | 25.00 | 0.56 | 30.30 | |
| 第三次 | 25.00 | 0.20 | 26.45 | |
参考答案:(1)浅红色变为无色且半分钟内不恢复 (2)D ? (3) 26.10
(4)V=26.20 ml,(第二次偏差太大,舍去)
c(NaOH)=0.1000 mol/L×26.20 mL/25.00 mL=0.1048 mol/L
本题解析:略
本题难度:一般
3、选择题 对于常温下pH为1的硝酸溶液,下列叙述正确的是(?)
A.该溶液1 mL稀释至100 mL后,pH等于3
B.向该溶液中加入pH为13的氢氧化钡溶液恰好完全中和
C.该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为10-12
D.该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍
参考答案:A
本题解析:硝酸为强电解质,完全电离,稀释100倍,pH增大2,A项正确。不知道HNO3和Ba(OH)2溶液的体积,B项错。硝酸电离出的c(H+)为0.1 mol·L-1,由水电离出的c(H+)为10-13 mol·L-1,二者之比应为1012,C项错。pH为3的硝酸中水电离出的c(H+)为10-11 mol·L-1,故D项应为10-2,D项错。
本题难度:一般
4、填空题 (10分)在一定温度下,醋酸溶液存在电离平衡:
CH3COOH? ?CH3COO- + H+
?CH3COO- + H+
(1)某温度时,0.1mol/L的醋酸溶液中的c(H+) 与0.01mol/L c(H+)的比值? _________________(填“大于”、“小于”或“等于”)10
(2)已知:25℃时,该电离平衡的平衡常数为1.75×10-5
①求该温度时,amol/L的醋酸溶液中c1(H+)="________________mol/L" (用含a的代数式表示)。[提示:此时a比较小,进行简化计算,平衡时c(CH3COOH)可用初始浓度代替,水电离出的c(H+) 、c(OH-)忽略不计,下同]
②若该温度时向该溶液中加入一定量的CH3COONH4(假设溶液体积不变),使溶液中c(CH3COO-)为bmol/L,则此时c2(H+)=________________mol/L(用含a、b的代数式表示).
③c1(H+)__________? c2(H+)(填“大于”、“小于”或“等于”)
参考答案:(10分)(1)<?(2)①?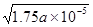 ?②(1.75a×10-5)/b?③>
?②(1.75a×10-5)/b?③>
本题解析:(1)醋酸是弱酸,存在电离平衡,所以浓度越大,电离程度越小,所以0.1mol/L的醋酸溶液中的c(H+) 与0.01mol/L c(H+)的比值小于10。
(2)①醋酸的电离方程式为CH3COOH CH3COO-+H+,所以根据醋酸的电离平衡常数表达式
CH3COO-+H+,所以根据醋酸的电离平衡常数表达式 可知,氢离子浓度是c1(H+)=
可知,氢离子浓度是c1(H+)=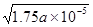 。
。
②根据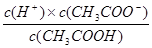 可知,此时氢离子浓度是
可知,此时氢离子浓度是
c2(H+)=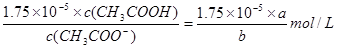 。
。
③由于醋酸铵能抑制醋酸的电离,所以c1(H+)大于 c2(H+)。
本题难度:一般
5、选择题 某温度下, pH值相同的盐酸和醋酸溶液分别稀释,平衡pH值随溶液体积变化的曲线如下图所示。据图判断下列叙述中,正确的是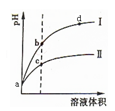
A.曲线Ⅰ为醋酸稀释时pH值变化曲线
B.b点溶液中水的电离程度比c点溶液中水的电离程度大
C.a点时,加入相同大小的锌粒,与盐酸反应的速率大
D.加入足量NaOH,b点溶液消耗的NaOH比c点溶液消耗的多
参考答案:B
本题解析:
正确答案:B
A.不正确,曲线Ⅰ为盐酸稀释时pH值变化曲线,醋酸是弱酸,稀释时pH值变化曲线Ⅱ;
B.正确,b点酸性小,对溶液中水的电离程度抑制小,比c点溶液中水的电离程度大;
C.不正确,a点时,加入相同大小的锌粒,两者H+ 的浓度相同,反应的速率相同;
D.不正确,加入足量NaOH,b点溶液消耗的NaOH比c点溶液消耗的少,c点浓度大。
本题难度:简单