时间:2025-06-25 22:18:36
1、实验题 铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
□Fe2++□ClO-+?=□Fe(OH)3↓+□C1-+?
②检验滤液B中是否还含有铁元素的方法为:??(注明试剂、现象)。
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为?(填代号)。
a.氢氧化钠溶液? b.硫酸溶液? c.氨水? d.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、?(填操作名称)、洗涤。
(2)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在。目前研究比较热门的Al-H2O2燃料电池,其原理如右图所示,电池总反应如下:2Al+3HO2-=2AlO2-+OH-+H2O
①正极反应式为?。
②Al电极易被NaOH溶液腐蚀,这是该电池目前未能推广使用的?
原因之一,电极被腐蚀的离子方程式为?。
(3)钢材镀铝可以防止钢材腐蚀,在镀铝电解池中电解液采用熔融盐(成分NaCl、KCl,电镀时氯元素和铝元素主要以AlCl4-形式存在)。不采用氯化铝溶液的原因是?。
(4)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为?(填代号)。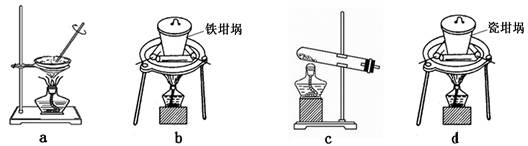
参考答案:(14分)(1)①2Fe2++ClO-+5H2O=2Fe(OH)3↓+C1-+4H+(2分)
②取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素。
(其他合理答案均得分)(2分)?③ c(1分)?④过滤(1分)
(2)①HO2-+2e-+H2O=3OH-(2分)?②2Al+2OH-+2H2O=2AlO2-+3H2↑(2分)
(3)氯化铝溶液中,H+得电子能力强于Al3+,电镀池中阴极析出氢气(2分)?(4)b(2分)
本题解析:(1)①根据方程式可知,铁元素的化合价从+2价升高到+3价,失去1个电子。氯元素的化合价从+1价,降低到-1价,得到2个电子,则根据电子的得失守恒可知,还原剂与氧化剂的物质的量之比是2:1。根据原子守恒与电荷守恒可知,反应前有水参加,反应后有氢离子生成,因此配平后的方程式是2Fe2++ClO-+5H2O=2Fe(OH)3↓+C1-+4H+。
②由于铁离子能和KSCN溶液发生显色反应,可以鉴别铁离子。而亚铁离子检验还原性,能被氯水氧化生成铁离子,据此可以鉴别滤液B是否含有铁元素。即取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素。
③滤液B中的铝元素以Al3+的形式存在,要以沉淀形式析出,需要加入碱液。由于氢氧化铝是两性氢氧化物,所以不能选择强碱,最好选择弱碱氨水,答案选c。
④冷却结晶后有晶体析出,因此分离出晶体的实验操作应该是过滤。
(2)①原电池中负极,失去电子,正极得到电子。则根据方程式2Al+3HO2-=2AlO2-+OH-+H2O可知,负极是铝失去电子,正极是HO2-得到电子,所以正极的电极反应式是HO2-+2e-+H2O=3OH-。
②金属铝能被氢氧化钠溶液溶解,生成偏铝酸钠和氢气,反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑。
(3)铝是活泼的金属,金属活动顺序表中位于氢的前面,在氯化铝溶液中,H+得电子能力强于Al3+,电镀池中阴极析出氢气,Al3+不放电,得不到金属铝。
(4)a是蒸发。不能熔融二氧化硅和氢氧化钠,不正确;b是铁坩埚,可以熔融二氧化硅和氢氧化钠,正确;c是试管,不能熔融二氧化硅和氢氧化钠,不正确;d是瓷坩埚,瓷坩埚中含有二氧化硅能和氢氧化钠反应,不能熔融氢氧化钠,不正确,答案选b。
本题难度:一般
2、选择题 用铝热法还原下列物质,制得金属各1摩尔,消耗铝最少的是
A.MnO2
B.FeO
C.Cr2O3
D.V2O5
参考答案:B
本题解析:铝热为氧化还原反应,氧化还原反应的本质是电子的转移,其得失电子数相同;、MnO2中Mn元素为+4价,制备1摩尔Mn需转移4摩尔电子;FeO中Fe元素为+2价,制备1摩尔Fe需转移2摩尔电子;Cr2O3 中Cr元素为+3价,制备1摩尔Cr需转移3摩尔电子;V2O5中V元素的化合价为+5价,制备1摩尔V需转移5摩尔电子;所以制得金属各1摩尔,消耗铝最少的是FeO,选项B正确;
本题难度:一般
3、选择题 以下有关物质用途的叙述错误的是?
A.明矾:净水剂
B.四氯化碳:灭火剂
C.四氧化三铁:红色颜料
D.小苏打:治胃酸过多
参考答案:C
本题解析:四氧化三铁为红色晶体,不能作红色颜料。
本题难度:一般
4、选择题 某活泼金属在空气中易与氧气反应,在表面生成一层致密的氧化膜,可以保护内层金属不被继续氧化;该金属是
A.铝
B.钠
C.铁
D.铜
参考答案:A
本题解析:略
本题难度:一般
5、实验题 右图中所示装置的实验如下:先关闭K,使A中反应进行,加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质。实验完成后将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成。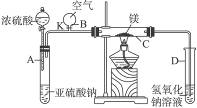
(1)C中的Mg应放在不锈钢垫片上而不能直接接触管壁,这是因为___________________
______________________________________________________________________________。
(2)停止实验时,先打开K,再停止滴加浓硫酸并熄灭酒精灯,橡胶气胆B在实验中的作用是______________________________________________________________________________。
(3)C中全部反应产物有______________、______________、______________。(填化学式)
参考答案:(1)4Mg+SiO2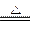 2MgO+Mg2Si
2MgO+Mg2Si
(2)补充气体,维持玻璃管C中的压强与外界大气压相等,避免试管C在撤去酒精灯后,压强降低,D中液体产生倒流
(3)MgO? MgS? S
本题解析:(1)一般两种物质不能直接接触,应考虑两者之间可能发生化学反应。Mg是强还原剂,可能与SiO2反应,夺取SiO2中的氧元素。
(2)NaOH溶液是用来吸收SO2的,若根据一般的操作顺序:先撤导管,再熄灭酒精灯,这样虽不会倒流,但会污染空气。按题中操作顺序,虽不会造成大气污染,但若不维持C管里的压强,肯定会倒流,所以气胆B的作用是被充气体维持C中的压强。
(3)题中所列现象,由已熟悉CO2与Mg反应的产物可判断C中全部反应产物。冒白烟即产生了MgO,淡黄色固体肯定为S,与酸反应产生了H2S,生成物中一定有MgS。
本题难度:简单