时间:2025-06-25 22:06:20
1、选择题 图示装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于(?)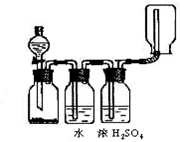
A 锌和盐酸发生氢气
B 二氧化锰和浓盐酸生成氯气
C 碳酸钙和盐酸生成二氧化碳
D 氯化钠和浓硫酸生成氯化氢
参考答案:A
本题解析:根据装置可知,反应不需要加热,且收集的气体难溶于水,密度小于空气的,所以选项A正确,答案选A。B、要加热,Cl2密度大于空气;C、CO2密度大于空气;D、HCl极易溶于水。
本题难度:简单
2、填空题 实验室用NaOH 固体配制1.0mol/L的NaOH溶液500mL,回答下列问题
(1)配制溶液所需仪器为:容量瓶(规格:?)、托盘天平,还需要那些实验仪器才能完成该实验,请写出:? ?。
?。
(2)在容量瓶的使用方法中,下列操作不正确的是(填编号)_? __。
__。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗 净后,再用待配溶液润洗
净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2cm处,用胶头滴管加蒸馏水到刻度线
D.配制溶液时,如果试样是液体, 用量筒量取试样后,直接倒入容量瓶中,缓慢加入蒸馏水到标线
用量筒量取试样后,直接倒入容量瓶中,缓慢加入蒸馏水到标线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶反复上下颠倒、摇匀
F.往容量瓶中转移溶液时应用玻璃棒引流
(3)在配制一定物质的量浓度的NaOH溶液时,下列哪个原因会造成所配溶液浓度偏高?B
A.称量固体NaOH时,有潮解现象?B.定容时俯视容量瓶的刻度线观察液面
C.称量时误用“左码右物”?
D.溶解后移液直接转移至容量瓶中,未冷却溶液
E.未洗涤烧杯以及玻璃棒?F.定容时仰视容量瓶的刻度线观察液面
G. 定容后,加盖倒转摇匀后,发现液面低于刻度线,又加水至刻度?
定容后,加盖倒转摇匀后,发现液面低于刻度线,又加水至刻度?
H.容量瓶中原有少量蒸馏水。
参考答案:(1)500(2分),烧怀、药匙、玻璃棒、胶头滴管(2分)。
(2)BCD(2分)。(3)BD(2分)
本题解析:略
本题难度:简单
3、填空题 (14分)欲用36.5%(密度为1.18g/cm3)的浓盐酸配制浓度为1.00mol/L的稀盐酸500mL。

(1)选用的主要玻璃仪器有:①?②?③?④?⑤?。
(2)现有下列配制操作,正确的操作顺序为:?(填字母)
A.用量筒量取浓盐酸;
B.反复颠倒摇匀;
C.用胶头滴管加水至刻度线;
D.洗净所用仪器,洗涤液也转入容量瓶;E.稀释浓盐酸;F.溶液冷却后转入容量瓶。
(3)简要回答下列问题:
如果实验室有10mL、50mL、100mL的量筒,应选用?mL的量筒。量取时发现量筒不干净,用水洗净后直接量取,将使配制的溶液浓度?(填“偏高”、“偏低”或“无影响”)。
参考答案:(1)① 烧杯②玻璃棒 ③500mL容量瓶 ④胶头滴管⑤量筒
(2)AEFD(B)CB?(3分)?(3) 50 ?、?偏低 。
本题解析:略
本题难度:简单
4、选择题 实验室里气体的除杂或尾气的收集,选用装置正确的是?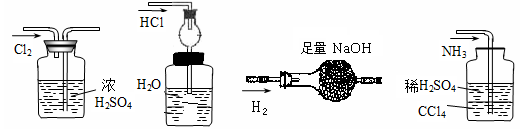
A.干燥Cl2
B.吸收HCl
C.干燥H2
D.吸收NH3
参考答案:D
本题解析:A.图示的干燥装置中,进气导管连接错误,无法对Cl2进行干燥,图中操作错误应长管进短管出,故A错误;B.倒置球形漏斗插入溶液中,气体能被充分吸收,且球形管有缓冲作用而防止倒吸,但该装置密封,导致装置内压强瞬间减小,产生倒吸,所以B错误;C.该装置用干燥管干燥氢气,所以,选择固体干燥剂,虽氢氧化钠能吸水,但干燥效果差,一般不作干燥剂,可选择碱石灰等常用的干燥剂,故C错误;D.氨气易溶于水,更易溶于稀硫酸,用稀硫酸吸收时要防止倒吸,氨气不溶于CCl4,四氯化碳密度比硫酸大,在下层,将氨气通入到CCl4,不会产生倒吸,然后氨气通过硫酸吸收,故D正确;故选D。
本题难度:一般
5、填空题 氨化铁是常见的水处理剂,无水晶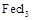 易升华。工业上制备无水的
易升华。工业上制备无水的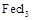 的一种工艺如图所示:
的一种工艺如图所示: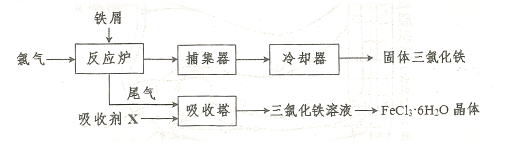
(1)加入吸收塔的吸收剂X应是?(填字母编号)。
a.NaOH溶液? b.饱和食盐水? c.FeCl2溶液? d.淀粉KI溶液
(2)取0.5mL饱和FeCl3溶液滴入50mL沸水中,得红褐色氢氧化铁胶体,则发生反应的离子方程式为?,胶体粒子的直径一般不超过?。
(3)实验室中从FeCl3溶液制得FeCl3·6H2O晶体的过程中,需先加入?且保持过量,然后进行的操作依次为?、冷却结晶、过滤。
(4)将H2S气体通入FeCl3溶液中会出现浑浊,则其反应的离子方程式为?。
(5)铁铬氯化还原液流电池是一种低成本的储能电池,电池结构如图所示(电极材料为石墨),工作原理为:Fe3++Cr2+ Fe2++Cr3+,则电池放电时,Cl-将移向?极(填“正”或“负”);充电时,阴极的电极反应式为?。
Fe2++Cr3+,则电池放电时,Cl-将移向?极(填“正”或“负”);充电时,阴极的电极反应式为?。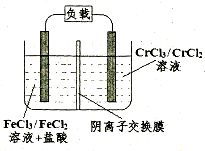
参考答案:
(1)c(2分)
(2)Fe3++3H2O? Fe(OH)3(胶体) +3H+?(2分)? 100nm(1分)
(3)盐酸 (2分)?蒸发浓缩(或加热蒸发)(2分)
(4)H2S+ 2Fe3+= 2Fe2++ S↓+2H+?(2分)?
(5)负 (1分)? Cr3++e-= Cr2+(2分)
本题解析:(1)通过工业上制备无水FeCl3的工艺流程图可知,从反应炉中排出的尾气是反应剩余的Cl2,与吸收剂X在吸收塔中反应生成FeCl3溶液,则吸收剂X应是FeCl2溶液。(3)从FeCl3溶液制得FeCl3·6H2O晶体的过程中,为抑制Fe3+的水解,需先加入盐酸且保持过量,然后依次进行蒸发浓缩、冷却结晶、过滤等操作。(4)H2S气体通入FeCl3溶液中,Fe3+将H2S氧化为S,Fe3+被还原为Fe2+。(5)电池工作时,电解质溶液中的阴离子移向负极,则铁铬氧化还原液流电池放电时,Cl-将移向负极;充电时,阴极发生还原反应,Cr3+得电子生成Cr2+。?3流程为切入点考查胶体、盐的水解、实验基本操作、Fe3+的氧化性、电化学的相关知识,同时考查学生的分析问题和解决问题能力。
本题难度:一般