时间:2025-06-25 22:06:20
1、选择题 拟用下图所示装置制取四种干燥、纯净的气体(图中加热装置和气体的收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其不能达到目的的是: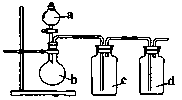
参考答案:C
本题解析:略
本题难度:一般
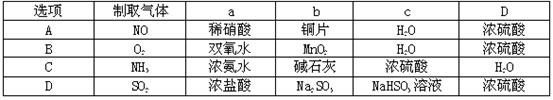
2、选择题 已知NH3极易溶于水,难溶于有机溶剂,下列装置宜用于NH3尾气吸收的是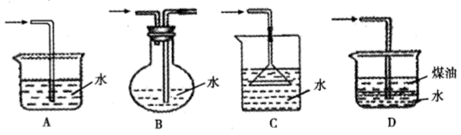
参考答案:B
本题解析:因NH3极易溶于水所以管若直接插入水中易引起倒吸,A、C、D均会产生倒吸。答案选B。
本题难度:简单
3、实验题 某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。请回答下列问题: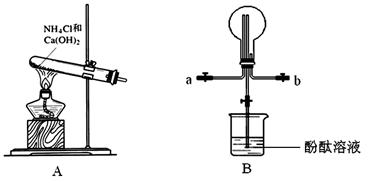
(1)实验室制备氨气的化学方程式为?;干燥氨气常用的干燥剂是?。
(2)收集氨气时,请你选择氨气的进气口?(填“a”或“b”)。
(3)①、若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是?。
②、若装置B中的烧瓶充满干燥气体,烧杯中盛有液体,下列组合中不可能形成喷泉的是?
A、HCl和H2O? B、H2和H2O? C、CO2和NaOH?
(4)氨气在催化剂并且加热时会被空气氧化,这是工业制硝酸的第一步反应,写出该反应的化学方程式?。
参考答案:(1)2NH4Cl+Ca(OH)2==2NH3↑+2H2O+CaCl2?(2分)?碱石灰 (1分)
(2)a?(1分)
(3)①NH3极易溶于水且水溶液呈碱性(2分)?②B(2分)
(4)4NH3+5O2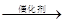 4NO+6H2O(2分)
4NO+6H2O(2分)
本题解析::(1)实验室用加热氯化氨和消石灰的固体混合物制取氨气,故答案为:2NH4Cl+Ca(OH)2 2NH3↑+2H2O+CaCl2;得到的氨气为碱性气体,可以用碱石灰(碱性干燥剂,氢氧化钠固体和氧化钙的混合物)干燥。
2NH3↑+2H2O+CaCl2;得到的氨气为碱性气体,可以用碱石灰(碱性干燥剂,氢氧化钠固体和氧化钙的混合物)干燥。
(2)氨气的式量为17,空气的平均式量为29,氨气密度小于空气的密度,所以要采用向下排空气法收集氨气,即a?为进气口,b为出气口,故答案为:a;
(3)①、氨气溶于水生成氨水,氨水电离出自由移动的氢氧根离子,所以溶液呈碱性,加入酚酞后溶液呈红色;
②、氨气形成喷泉的原理是由于氨气极易溶于水,氨气溶于水而导致烧瓶内压强减小,从而形成喷泉。依据氨气形成喷泉的原理,如要形成喷泉,烧瓶内气体溶于水导致烧瓶内压强减小,外界大气压将烧杯内液体压入到烧瓶内,从而形成喷泉;因为H2不溶于水,不能形成喷泉,所以本题选B。
(4)氨催化氧化法制硝酸的步骤:氨气催化氧化为一氧化氮、一氧化氮和氧气反应生成二
氧化氮、二氧化氮和水反应生成硝酸,故答案为:4NH3+5O2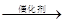 4NO+6H2O。
4NO+6H2O。
点评:本题考查氨气的制取和性质等知识,题目较为综合,具有一定难度,熟练掌握实验室中制取氨气的反应原理,氨气的性质是解答本题的关键。
本题难度:一般
4、简答题 某学生用图示的装置进行一氧化碳和二氧化碳混合气体的分离和干燥.其中a为铁夹,b为分液漏斗的活塞.
(1)甲瓶内盛______?溶液,乙瓶内盛______溶液,分液漏斗内盛______溶液.
(2)实验先分离出一氧化碳,方法是先关闭______,再打开______.
(3)分离完一氧化碳后,再收集二氧化碳,方法是先关闭______,再打开______.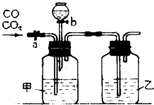
参考答案:(1)依据实验要求可知甲、乙装置应分别为除杂和干燥装置,根据CO和CO2性质可知甲是用以吸收CO2的,因此甲、乙应分别装NaOH溶液和浓H2SO4,甲吸收CO2后最后还应将其释放出来,显然b中应盛放酸,由于盐酸有挥发性,宜选择H2SO4.
故答案为:氢氧化钠;硫酸;浓硫酸;
?(2)根据(1)的分析可知先分离得到的是CO气体,应关闭b打开a,故答案为:b;a;
(3)根据(2)分析知 后得到CO2气体,所以要打开b让硫酸和碳酸钠反应生成二氧化碳,关闭a防止再进入CO,所以应关闭a打开b,故答案为:a;b.
本题解析:
本题难度:一般
5、选择题 利用以下装置能实现预想的是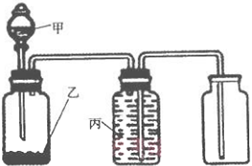
| 选项 | 甲 | 乙 | 丙 | 实验目的 |
| A | 浓氨水 | NaOH | 饱和食盐水 | 制取并收集氨气 |
| B | 浓盐酸 | MnO2 | 饱和食盐水 | 制取并收集氯气 |
| C | 稀硝酸 | Cu | 水 | 制取并收集一氧化氮 |
| D | 稀硝酸 | Zn | 水 | 制取并收集氢气 |
参考答案:D
本题解析:A、NaOH溶于浓氨水放热,使NH3?H2O分解为氨气和水,氨气的溶解度比食盐大,不能用排水法除杂,氨气密度比空气小,不能用向上排气法收集,错误;B、MnO2氧化浓盐酸必须加热,图中无加热仪器,错误;C、Cu能将稀硝酸还原为为NO,NO不溶于水,可用排水量气法收集并除去NO中混有的硝酸蒸气,正确;D、稀硝酸是氧化性酸,NO3—的氧化性比H+强,因此还原产物中没有氢气,只有含氮物,错误。
本题难度:一般