时间:2025-06-25 21:47:33
1、计算题 将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)  xC(g)+2D(g),经5min后,测得D的浓度为0.5 mol·L-1,C的平均反应速率是0.1 mol·L-1·min-1,且c(A)﹕c(B)=3﹕5。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5 mol·L-1,C的平均反应速率是0.1 mol·L-1·min-1,且c(A)﹕c(B)=3﹕5。求:
⑴、此时A的浓度c(A)=?____ mol·L-1;
⑵、反应开始前放入容器中B物质的量n(B)=?____ mol;
⑶、B的平均反应速率v(B)=?___ mol·L-1·min-1;
⑷、x=?____ 。
参考答案:⑴、c(A)= 0.75 mol·L-1?
⑵、n(B)=?3?mol
⑶、v(B)=?0.05?mol·L-1·min-1?
⑷、x=?2
本题解析:
本题难度:一般
2、选择题 在2L的密闭容器中,发生以下反应:2A(g)+B(g)=2C(g)+D(g),若最初加入的A和B都是4mol,在前10s
A的平均反应速率为0.08mol/(L·s),则10s时容器中B的物质的量是
[? ]
A.3.6mol
B.3.2mol
C.2.4mol
D.1.2mol
参考答案:B
本题解析:
本题难度:简单
3、选择题 在一定温度下,向a L密闭容器中加入1 mol X气体和2mol Y气体,发生如下反应:X(g) + 2Y(g)?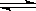 2Z(g) 此反应达到平衡的标志是
2Z(g) 此反应达到平衡的标志是
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为l : 2 : 2
D.单位时间消耗0.1 mol X同时生成0.2 mol Z
参考答案:AB
本题解析:略
本题难度:一般
4、选择题 将3 molO2加入到V L的反应器中,在高温下放电,经t1s建立了平衡体系:3O2 2O3,此时测知O2的转化率为30%,下列图象能正确表示气体的物质的量浓度(m)跟时间(t)的关系的是(?)
2O3,此时测知O2的转化率为30%,下列图象能正确表示气体的物质的量浓度(m)跟时间(t)的关系的是(?)
图2-57
参考答案:C
本题解析:3O2 2O3
2O3
n(始):? 3? 0
n(变):? 0.9? 0.6
n(平):? 2.1?0.6
故C符合变化。
本题难度:一般
5、实验题 在一定温度下,把2 mol N2和6 mol H2通入一个体积不变的密闭容器中,(如右图):容器中发生以下的反应:
N2(g)+3 H2(g) 2NH3 (g)?(正反应为放热反应)
2NH3 (g)?(正反应为放热反应)
若反应达到平衡后,测得混和气体为7 mol ,据此回答下列问题:
保持上述反应温度不变,使a、b、c分别代表初始加入的N2、H2和NH3的物质的量,如果反应达到平衡后混和气体中各物质的物质的量分数仍与上述平衡时完全相同,那么:
(1)若a="1" mol ,c="2" mol ,则b="____" mol,在此情况下,反应起始时将向?方向进行(填 “正”或“逆”)
(2)若规定起始时反应向逆反应方向进行,则c的范围是?。
(3)在上述装置中,若需控制平衡后的混和气体的物质的量为6.5 mol,则可采取的措施是?
参考答案:1)b="__3____" mol,? __逆反应__?方向进行(2)? 1<c≤4? ___?。
(3)措施是?降低温度
本题解析:略
本题难度:简单