时间:2025-06-25 21:46:44
1、选择题 向某密闭容器中加入0.6 mol A、0.2 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[其中t0-t1阶段c(B)未画出]。t2时刻后改变条件反应体系中反应速率随时间变化的情况如乙图所示,且四个阶段都各改变一种条件并且改变的条件均不相同。下列说法正确的是(?)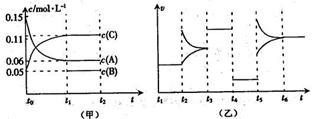
 A.反应的方程式为3A(g)+B(g)? 2C(g)
A.反应的方程式为3A(g)+B(g)? 2C(g)
B.t3~t4,t4~t5,t5~t6各阶段可能改变的条件依次为:加催化剂,降低反应温度,增大压强
C.B的起始物质的量为0.08 mol
D.若t1="10" s,A在t0~t1时间段的反应速率为0.00225 mol·L-1·s-1?
参考答案:C
本题解析:A、根据图甲可知反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,则t4~t5阶段应为减小压强,则该反应中气体的化学计量数之和前后相等,则有:3A(g) B(g)+2C(g),错误;B、t4~t5阶段应为减小压强,错误;C、A的起始物质的量为0.6 mol ,起始浓度为0.15mol?L?1,可知容器体积V=4L,根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为4L,生成B的物质的量为0.12mol,平衡时B的物质的量为0.2mol,所以起始时B的物质的量为0.2mol-0.12mol=0.08mol,正确;D、A在t0~t1时间段的反应速率为:0.09mol/L÷10s="0.009" mol·L-1·s-1,错误。
B(g)+2C(g),错误;B、t4~t5阶段应为减小压强,错误;C、A的起始物质的量为0.6 mol ,起始浓度为0.15mol?L?1,可知容器体积V=4L,根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为4L,生成B的物质的量为0.12mol,平衡时B的物质的量为0.2mol,所以起始时B的物质的量为0.2mol-0.12mol=0.08mol,正确;D、A在t0~t1时间段的反应速率为:0.09mol/L÷10s="0.009" mol·L-1·s-1,错误。
本题难度:一般
2、选择题 在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是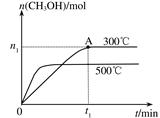
A.该反应的△H<0
B.其他条件不变,升高温度反应的平衡常数增大
C.300℃时,0-t 1min内 CH3OH的平均生成速率为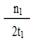 mol·L-1 min-1
mol·L-1 min-1
D.A点的反应体系从300℃升高到500℃,达到平衡时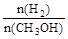 减小
减小
参考答案:AC
本题解析:A、由图象可知,温度越高,平衡时甲醇的物质的量越小,故升高温度平衡向逆反应方向移动,该反应正反应是放热反应,即△H<0,正确;B、由图象可知,温度越高,到达平衡时甲醇的物质的量越小,升高温度平衡向逆反应移动,平衡常数减小,错误;C、根据反应速率的计算公式及题给数据计算,300℃时,0-t 1min内 CH3OH的平均生成速率为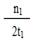 mol·L-1 min-1,正确; D、A点的反应体系从300℃升高到500℃,甲醇的物质的量减小,平衡向逆反应,氢气的物质的量增大,故达到平衡时
mol·L-1 min-1,正确; D、A点的反应体系从300℃升高到500℃,甲醇的物质的量减小,平衡向逆反应,氢气的物质的量增大,故达到平衡时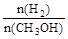 增大,错误。
增大,错误。
本题难度:一般
3、选择题 下列说法不正确的是( )。
A.原电池负极被氧化
B.任何化学反应都能设计成原电池
C.化学反应的速率和限度均可通过改变化学反应条件而改变
D.化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变
参考答案:B
本题解析:原电池反应的本质是氧化还原反应,因此非氧化还原反应是不能设计成原电池的。
本题难度:简单
4、选择题 在一定温度下的恒容密闭容器中,能说明反应X2(g)+Y2(g)?2XY(g)已达到平衡的是( )
A.容器内的总压不随时间变化
B.容器中气体的平均相对分子质量不随时间变化
C.XY气体的物质的量分数不变
D.X2和Y2的消耗速率相等
参考答案:A,该反应方程式两边气体体积相等,根据气体压强之比等于气体物质的量之比推断,该反应在整个反应过程中总压强是不变的,压强不变,不能说明该反应已经达到平衡,故A错误;
B、根据A同理推断,容器中气体的平均相对分子质量始终不随时间变化,气体的平均相对分子质量不随时间变化,不能说明该反应已经达到平衡,故B错误;
C、XY气体的物质的量分数不变,表明各组分的浓度不变、正逆反应速率相等,达到了平衡状态,故C正确;
D、X2和Y2的化学计量数相等,其消耗速率始终相等,无法判断正逆反应速率是否相等,不能说明该反应已经达到平衡,故D错误;
故选C.
本题解析:
本题难度:简单
5、选择题 4molA和2molB放入2L密闭容器中发生反应2A(g)+B(g)?2C(g),△H<0.4s后反应达到平衡状态,此时测得C的浓度为0.6mol/L.下列说法正确的是( )
A.4s内,v(B)=0.075mol/(L?s)
B.当c(A):c(B):c(C)=2:1:2时,该反应即达到平衡状态
C.达到平衡状态后,若只升高温度,则C的物质的量浓度增大
D.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低
参考答案:A.v(C)=0.6mol/L4s=0.15mol/(L?s),反应速率之比等于化学计量数之比,则v(B)=0.075mol/(L?s),故A正确;
B.平衡时各物质的浓度关系取决于起始配比数以及反应的程度,不能作为判断达到平衡的依据,故B错误;
C.升高温度,平衡向逆反应方向移动,C的物质的量浓度减小,故C错误;
D.缩小容器的体积,压强增大,平衡向正反应方向移动,A的转化率增大,故D错误.
故选A.
本题解析:
本题难度:简单