时间:2025-06-25 21:46:44
1、选择题 一定温度下,在某固定容积的密闭容器中发生可逆反应A(g)+3B(g) 2C(g),能标志该反应达到平衡的是
2C(g),能标志该反应达到平衡的是
[? ]
A.A、B、C的浓度之比为1∶3∶2
B.单位时间内生成n molA的同时生成3n molB
C.单位时间内生成n molA的同时生成2n molC
D.混合气体的密度不变
参考答案:C
本题解析:
本题难度:一般
2、选择题 下图表示2A(g)+B(g) 2C(g) ΔH<0,这个反应的正确图像为(?)
2C(g) ΔH<0,这个反应的正确图像为(?)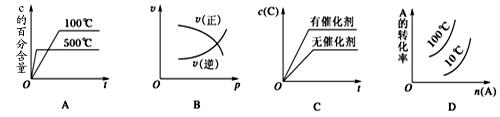
参考答案:A
本题解析:A、温度高,反应速率加快,先到达平衡;升高温度,平衡向吸热方向移动,即向逆反应方向移动,C的体积分数降低,故A正确;B、压强增大,正逆反应速率都增大,故B错误;C、使用催化剂,加快反应,到达平衡的时间短,但不影响平衡的移动,平衡时C的浓度不变,故C错误;D、增大压强反应向体积减小方向移动,即向正反应方向移动,A的转化率增大;升高温度,平衡向吸热方向移动,即向逆反应方向移动,A的转化率降低,故D错误;故选A.
本题难度:一般
3、选择题 在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应:A(s)+3B(g)?2C(g)+D(g)已达平衡状态的是( )
A.混合气体的压强
B.混合气体的密度
C.A的物质的量浓度
D.气体的总物质的量
参考答案:A、反应两边是气体的化学计量数相等,反应中压强始终不变,所以压强无法判断是否达到了平衡状态,故A错误;
B、由于A是固体,反应两边气体的质量不相等,容器的容积固定,气体的体积不变,所以混合气体的密度是个变量,混合气体的密度不变,说明正逆反应速率相等,达到了平衡状态,故B正确;
C、由于A是固体,所以A的量不能判断是否达到了平衡状态,故C错误;
D、反应两边气体的体积相等,气体的物质的量始终不变,所以物质的量无法判断是否达到了平衡状态,故D错误;
故选:B.
本题解析:
本题难度:简单
4、选择题 一定条件下,在某容积固定的密闭容器中进行反应:2SO2(g)+O2(g)
?2SO3(g).下列说法中,可以说明反应达到化学平衡状态的是( )
A.SO2、O2、SO3共存
B.SO2、O2、SO3的总质量保持不变
C.SO2、O2、SO3的物质的量浓度不再发生变化
D.以SO2表示的正反应和逆反应速率相等,且等于零
参考答案:A、可逆反应在任何时候,SO2、O2、SO3都共存,故A错误;
B、根据质量守恒,可逆反应在任何时候,SO2、O2、SO3的总质量保持不变,故B错误;
C、化学反应达到平衡时,各物质的浓度不再改变,故C正确;
D、化学反应达到平衡时,正逆反应速率相等,但不等于零,故D错误;
故选C.
本题解析:
本题难度:简单
5、填空题 在10L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 K 0.6 0.9 1.0 1.7 2.6 |
参考答案:(1)升高温度,化学平衡常数增大,说明平衡向正反应方向移动,升高温度平衡向吸热反应移动,所以正反应方向是吸热反应,
故答案为:吸热;
(2)该反应的化学平衡常数K=C(CO)C(H2O)C(H2)C(CO2),故答案为:C(CO)C(H2O)C(H2)C(CO2);
(3)反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化.
a.该反应反应前后气体计量数不变,无论该反应是否达到平衡状态,容器中压强始终不变,故a错误;?
b.混合气体中?c(CO)不变时能说明该反应达到平衡状态,故正确;
c.υ正(H2)=υ逆(H2O),反应的方向一致,所以不能说明反应达到平衡状态,故错误;?
d.当c(CO2)=c(CO)时,反应不一定达到平衡状态,与反应物的初始浓度和转化率有关,故错误;
故答案为:b;
(4)根据反应方程式CO2(g)+H2(g)?CO(g)+H2O(g)知,参加反应的二氧化碳和一氧化碳的物质的量之比是1:1,生成一氧化碳的物质的量=0.0080mol/L×10L=0.08mol,所以消耗0.08mol二氧化碳,二氧化碳的转化率=0.08mol0.10mol×100%=80%,故答案为:80%;
(5)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),说明平衡常数K=1,所以该温度是830℃,故答案为:830.
本题解析:
本题难度:一般