时间:2025-06-25 21:46:44
1、填空题 研究NOx(氮的氧化物)SO2、CO等大气污染气体的测量及处理具有重要意义。
(1)下图是 反应过程中能量示意图。
反应过程中能量示意图。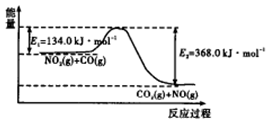
该反应的焓变
(2)一定条件下,通过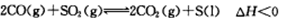 可以实现燃煤烟气中硫的回收。某研究小组向2L某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中通入CO和SO2,10分钟后测得容器CO2的物质的量为0.9mol。
可以实现燃煤烟气中硫的回收。某研究小组向2L某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中通入CO和SO2,10分钟后测得容器CO2的物质的量为0.9mol。
①求以v(CO2)表示的反应速率为?。
②该反应的平衡常数的表达式为:K=?。
③若想加快正反应速率的同时提高SO2的转化率,可以采用的方法是?。
(3)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应。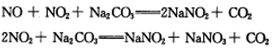
若用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则混合气体中NO和NO2的体积比为?。
参考答案:(1)-234.0(2分)
(2)①0.045 mol·L-1·min-1?(2分,没写单位不得分)
②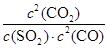 ? (2分)?③加压(或者增加CO浓度)? (2分)
? (2分)?③加压(或者增加CO浓度)? (2分)
(3)1:7(2分)
本题解析:(1)由图示知该反应为放热反应,故该反应焓变△H=-(368.0-134.0)kJ/mol=-234.0kJ、mol。(2)①v(CO2)=0.9mol÷(2L×l0min)=0.045mol/(L·min);②固体浓度视为常数,不计入平衡常数表达式,因此可利用反应方程式直接写出该反应的平衡常数表达式;③因正反应是气体体积减少的放热反应,因此可采取加压或增加CO的浓度来提高正反应速率且同时提高SO2的转化率。(3)利用题给反应条件知,每产生22.4 L标准状况下CO2,必有2mol氮的氧化物气体被吸收且混合气体的质量为88 g(放出CO2的质量与溶液增加质量的和),设88 g混合气体中含有NO、NO2的物质的量分别为。xmol、ymol,利用分析,结合题中数据可得:x+y=2、30x+46y=88,两式联立解得x="0.25" mol、y=1.75mol,故混合气体中V(NO):V(NO2)=n(NO):n(NO2)=0.25:1.75=1:7。
本题难度:一般
2、填空题 (一)、将2 mol SO2和1 mol O2气体在1L的容器中混合,在一定条件下发生如下反应:2SO2(g)+O2 (g)  ?2SO3 (g)。若经过2s后测得SO3的浓度为0.6 mol/ L。试计算:(1)O2的化学反应速率V(O2)=?; (2)2s时的O2浓度?。
?2SO3 (g)。若经过2s后测得SO3的浓度为0.6 mol/ L。试计算:(1)O2的化学反应速率V(O2)=?; (2)2s时的O2浓度?。
(二)、某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如下图所示。
(1)X的转化率是?
(2)由图中所给数据进行分析,该反应的化学方程式为?;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=?;
(4)当反应进行到第?min,该反应达到平衡。
参考答案:(1) υ(O2)="0" .15mol/(L·s)? c(O2)=0.7? mol/L
(2) 30%? 3X+Y 2Z? 0.05mol/(l.·min)? 2
2Z? 0.05mol/(l.·min)? 2
本题解析:(一) 2s后测得SO3的浓度为0.6 mol/ L,所以V(O2)="0.5" V(SO2)=0.5 0.6/2=0 .15mol/(L·s),2s时的O2浓度=1-0 .15
0.6/2=0 .15mol/(L·s),2s时的O2浓度=1-0 .15 2=0.7 mol/L;
2=0.7 mol/L;
(二)由图可以知道,每反应0.1molY,和0.3molX就生成了0.2mol的Z,所以其反应的化学方程式为3X+Y 2Z,? X的转化率=0.3/1
2Z,? X的转化率=0.3/1 100%=30%,(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=0.2/2/2= 0.05mol/(l.·min);(4)由图可以看出,当反应时间为2min时,各物质的浓度均不再变化,所以当反应进行到第2min,该反应达到平衡。
100%=30%,(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=0.2/2/2= 0.05mol/(l.·min);(4)由图可以看出,当反应时间为2min时,各物质的浓度均不再变化,所以当反应进行到第2min,该反应达到平衡。
点评:本题考查了化学平衡,反应速率的相关计算,是高考考查的重点,该题综合性强,但难度不大。
本题难度:一般
3、选择题 在一定温度下,向aL密闭容器中加入1molX气体和2molY气体,发生如下反应:X(g)+2Y(g) 2Z(g),此反应达到平衡的标志是
2Z(g),此反应达到平衡的标志是
[? ]
A.容器内气体密度不随时间变化
B.v正(X): v逆(Y)= l:2
C.容器内X、Y、Z的浓度之比为1:2:2
D.单位时间消耗0.1 molX同时生成0.2molZ
参考答案:B
本题解析:
本题难度:一般
4、选择题 在一定的温度下,可逆反应A(g)+3B(g)
?2C(g)?达到平衡的标志是( )
A.单位时间生成nmolA,同时生成nmolC
B.A、B、C的分子数之比为1:3:2
C.单位时间生成nmolA,同时生成3nmolB
D.A、B、C的浓度不再变化
参考答案:A.对可逆反应A(g)+3B(g)
2C(g)来说,单位时间生成nmolA,同时生成2nmolC可以表示该反应的正逆反应速率才是相等的,故A错误;
B、A、B、C的分子数比为1:3:2,只是说明A、B、C的分子数之比等于化学计量数之比,不它仅能代表化学平衡状态的某种特殊情况,对判断一个可逆反应是否建立化学平衡没有普遍意义,故B错误;
B.生成A和生成B都代表逆反应速率.单位时间生成nmolA,同时生成3nmolB,只是说明了逆反应按照计量数生成A、B而已,不能说明正反应速率与逆反应速率相等,故C错误;
C.根据化学平衡的定义,可逆反应达到化学平衡状态时,反应物的浓度与生成物的浓度不再发生变化,因此可用“A、B、C的浓度不再变化”来判断该反应达到化学平衡状态,故D正确.
故选D.
本题解析:
本题难度:简单
5、选择题 在一定温度下的定容容器中,当下列物理量不再发生变化时,表明反应:A(s)+2B(g)?C(g)+D(g)已达平衡状态的是( )
A.混合气体的压强
B.混合气体的密度
C.A的密度
D.气体总物质的量
参考答案:A、可逆反应:A(s)+2B(g)?C(g)+D(g),反应前后,气体的物质的量不发生变化,体积恒定,反应自开始到平衡,压强都是一定值,故A错误;
B、A是固体,根据质量守恒,随着反应进行,气体的质量在增加,当气体的总质量不发生变化时,说明到达平衡状态,故B正确;
C、无论该反应是否达到平衡状态,A的密度始终不变,故C错误;
④该反应是一个反应前后气体体积不变的化学反应,无论该反应是否达到平衡状态,气体的总物质的量始终不变,故D错误.
故选B.
本题解析:
本题难度:一般